
沉默的“骨骼杀手”:揭秘骨质疏松的分子迷宫与治疗新局
人体内的骨骼,常被我们视作一副坚固、静止的支架,默默支撑着血肉之躯。然而,这副看似坚不可摧的“盔甲”实则充满活力,时刻处于破旧立新的动态平衡之中。当这种平衡被打破,一种被称为“沉默的杀手”——骨质疏松症(Osteoporosis, OP),便悄然而至。数据显示,全球有超过 2 亿人正遭受骨质疏松的折磨,其总体患病率高达 18.3%,在中国,50 岁以上人群的患病率也达到了 19.2% 。它不仅会导致疼痛和脊柱变形,更大大增加了骨折的风险,严重威胁着尤其是绝经后女性及老年群体的生存质量。
长期以来,公众对骨质疏松的认知往往停留在“缺钙”或“自然衰老”的层面,认为补钙就能万事大吉。然而,随着分子生物医学的深入探索,科学家们发现事情远非如此简单。骨质疏松的发生实际上是一场涉及基因遗传、免疫系统失控、氧化应激风暴、甚至肠道菌群叛变的复杂“内战”。现有的西医治疗虽然在一定程度上能抑制骨流失,但也面临着成本高昂、副作用频发(如颌骨坏死风险、心血管事件)等困境。面对这一全球性的健康挑战,我们不禁要问:在微观分子层面,骨骼究竟是如何一步步“瓦解”的?传统中医药与前沿生物技术又能为我们提供哪些新的破局思路?
本文将基于最新的综述研究,带您深入骨骼微观世界,解析骨质疏松错综复杂的分子发病机制,并探讨从经典西药到中草药,再到干细胞与人工智能的多元化干预策略。
1. 骨骼的微观战场:失衡的重塑
骨骼系统的健康依赖于一种被称为“骨重塑”(Bone Remodeling)的精妙机制。这就像是一个永不停歇的建筑工程:破骨细胞(Osteoclasts)充当“拆迁队”,负责吸收老旧或受损的骨组织;而成骨细胞(Osteoblasts)则是“建筑队”,负责合成新的骨基质并进行矿化。在健康状态下,两者配合默契,维持骨量的稳定。但在骨质疏松患者体内,这种平衡被打破——“拆迁”速度远快于“建设”,导致骨量净流失,骨微结构被破坏。
1.1 基因与衰老的“合谋”
这一失衡过程首先受到遗传因素的深刻影响。全基因组关联研究(GWAS)已经识别出近 600 个与骨质疏松和骨折相关的基因。除了DNA序列本身,表观遗传修饰(如DNA甲基化、组蛋白修饰和非编码RNA)也在其中扮演了关键角色。例如,特定的微小RNA(miRNA)如 miR-218 的活性降低,会直接抑制成骨细胞的活性 。
而衰老,则是这场危机的催化剂。随着年龄增长,体内的衰老细胞逐渐累积,它们不仅自身功能衰退,还会分泌各种有害因子,污染骨髓微环境。
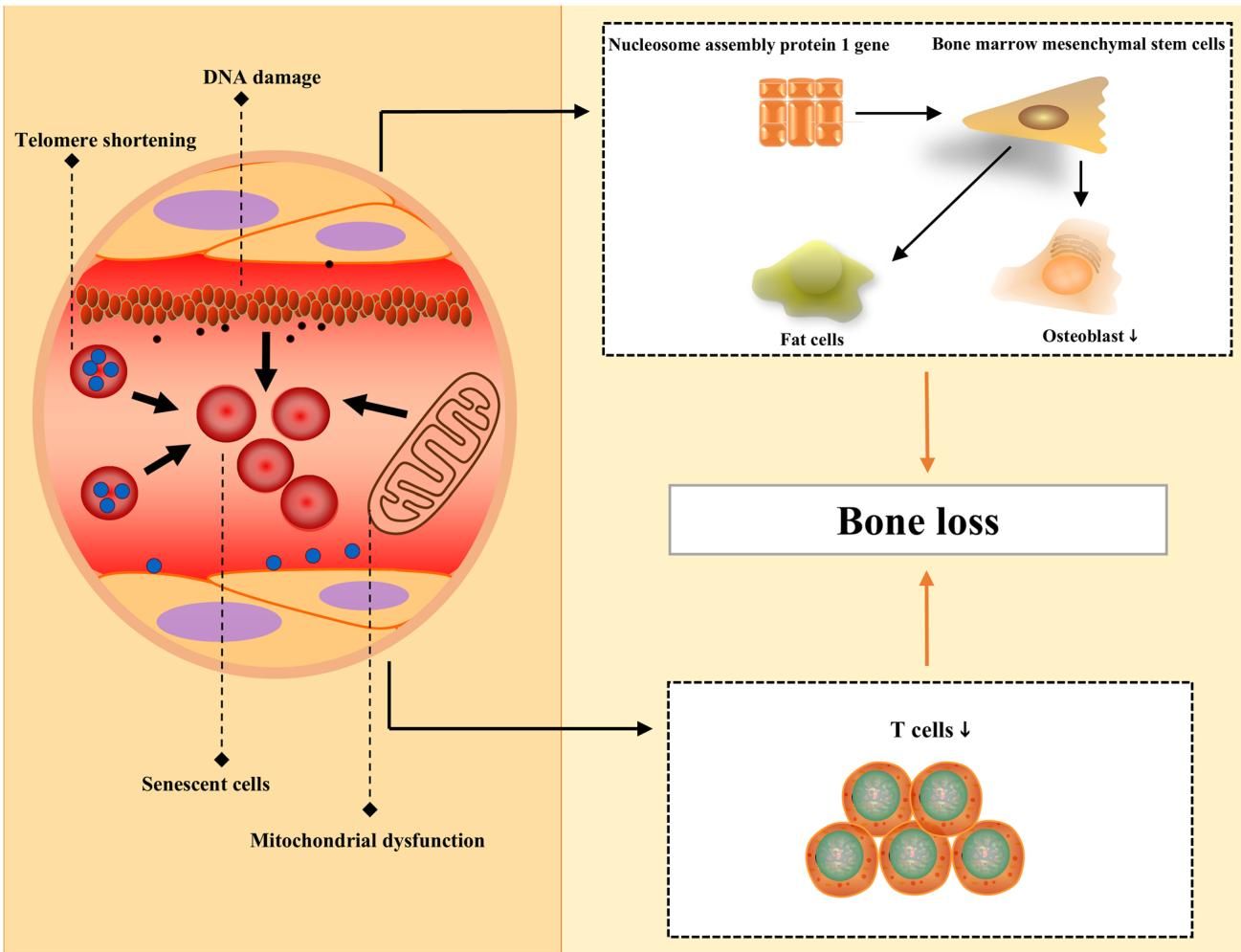
如图[1]所示,我们可以清晰地看到衰老对骨骼系统的多重打击。在细胞层面,端粒缩短和DNA损伤是衰老的典型标志,这些分子事件会导致线粒体功能障碍(图[1]左下角所示的红色线粒体异常),进而产生有害的活性氧。与此同时,核小体组装蛋白1基因的表达受到影响,导致骨髓间充质干细胞(BMSCs)“误入歧途”:它们不再分化为负责造骨的成骨细胞,而是异常转化为脂肪细胞(图[1]右上角所示),这就是为什么老年人的骨髓往往会变“油”且骨质变脆。此外,免疫系统中的T细胞功能在衰老过程中也会下降,进一步加剧了骨流失的进程。
2. 分子迷宫:多重机制的交织
骨质疏松的病理机制远不止衰老这么简单,它更像是一张错综复杂的信号网络,任何一个节点的异常都可能引发连锁反应。
2.1 信号通路的“交通堵塞”
骨代谢受到众多信号通路的严密调控,包括 TGF-β、Wnt、NF-κB 和 MAPK 等。这些通路就像是细胞间传递指令的“高速公路”。
- TGF-β 通路:作为维持骨稳态的重要因子,TGF-β 在骨吸收过程中被激活,通过下游的 SMAD 蛋白传递信号,防止过度的骨流失。
- Wnt 通路:这是骨形成的“主开关”。Wnt 配体(如 Wnt1, Wnt3A)能促进成骨细胞发育并抑制破骨细胞。一旦这条通路受阻,骨形成就会停滞 。
- NF-κB 与 MAPK 通路:这两条通路通常与炎症相关,它们被激活时会显著促进破骨细胞的分化和功能,是骨流失的“加速器” 。
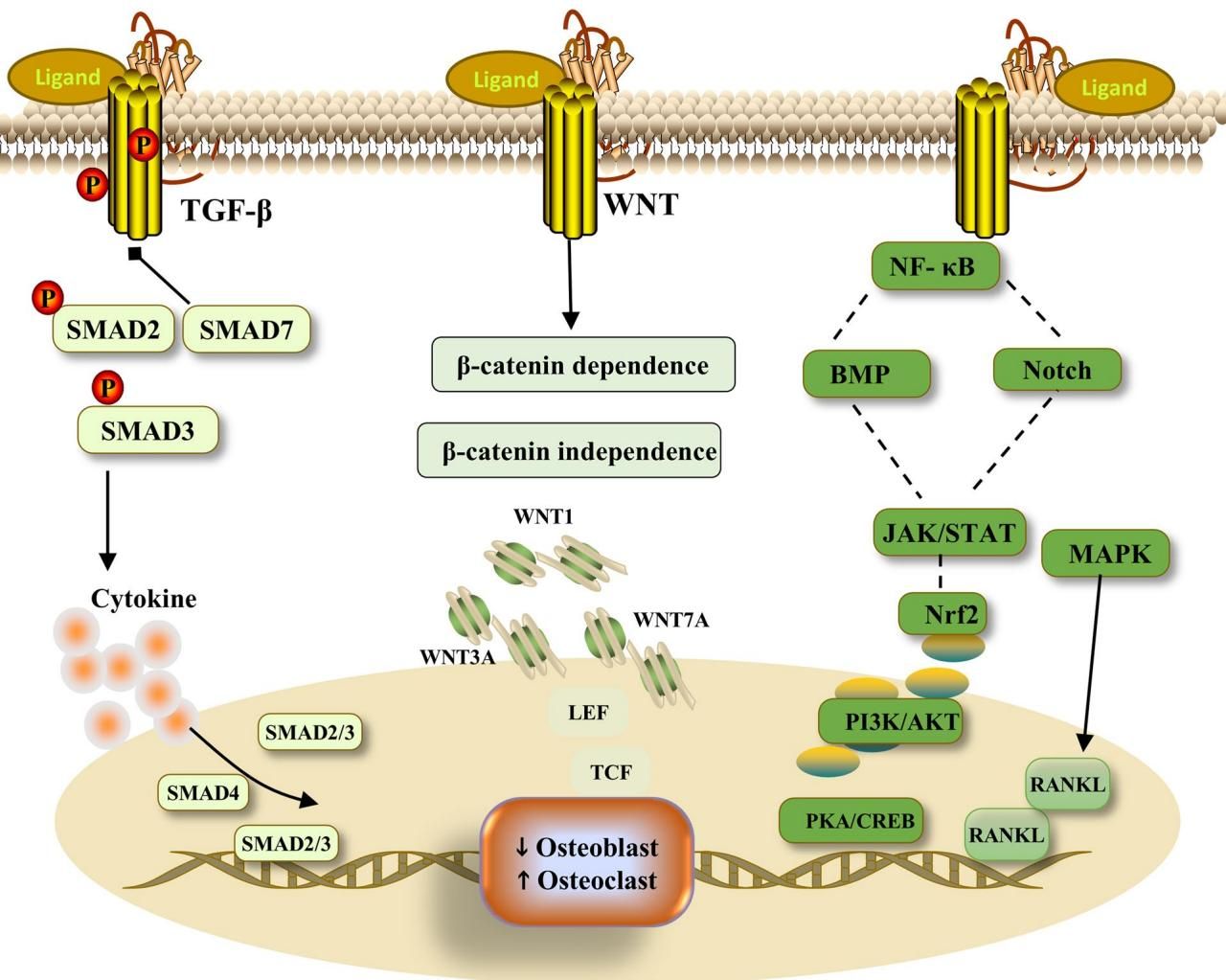
这种复杂的信号交互在图[2]中得到了生动的展示。我们可以看到,细胞膜上的配体与受体结合后,启动了多条级联反应。左侧的 TGF-β 通过 SMAD 蛋白复合物(SMAD2/3/4)进入细胞核调节基因表达;中间的 Wnt 信号则依赖 β-catenin 进入细胞核,启动成骨基因的转录;而右侧的 NF-κB 和 MAPK 通路则在 RANKL 等因子的刺激下,最终激活了破骨细胞的生成。这些通路并非孤立存在,而是像图[2]中虚线所示那样相互串扰,共同决定了骨骼的命运。
2.2 氧化应激与铁死亡:骨骼的“锈蚀”
除了信号传导,氧化应激(Oxidative Stress)也是近年来备受关注的致病机制。当体内的氧化与抗氧化平衡被打破,过量的活性氧(ROS)就会像铁锈一样侵蚀骨骼健康。ROS 不仅直接抑制成骨关键转录因子 Runx2 的活性,还会诱导一种特殊的细胞死亡方式——铁死亡(Ferroptosis)。
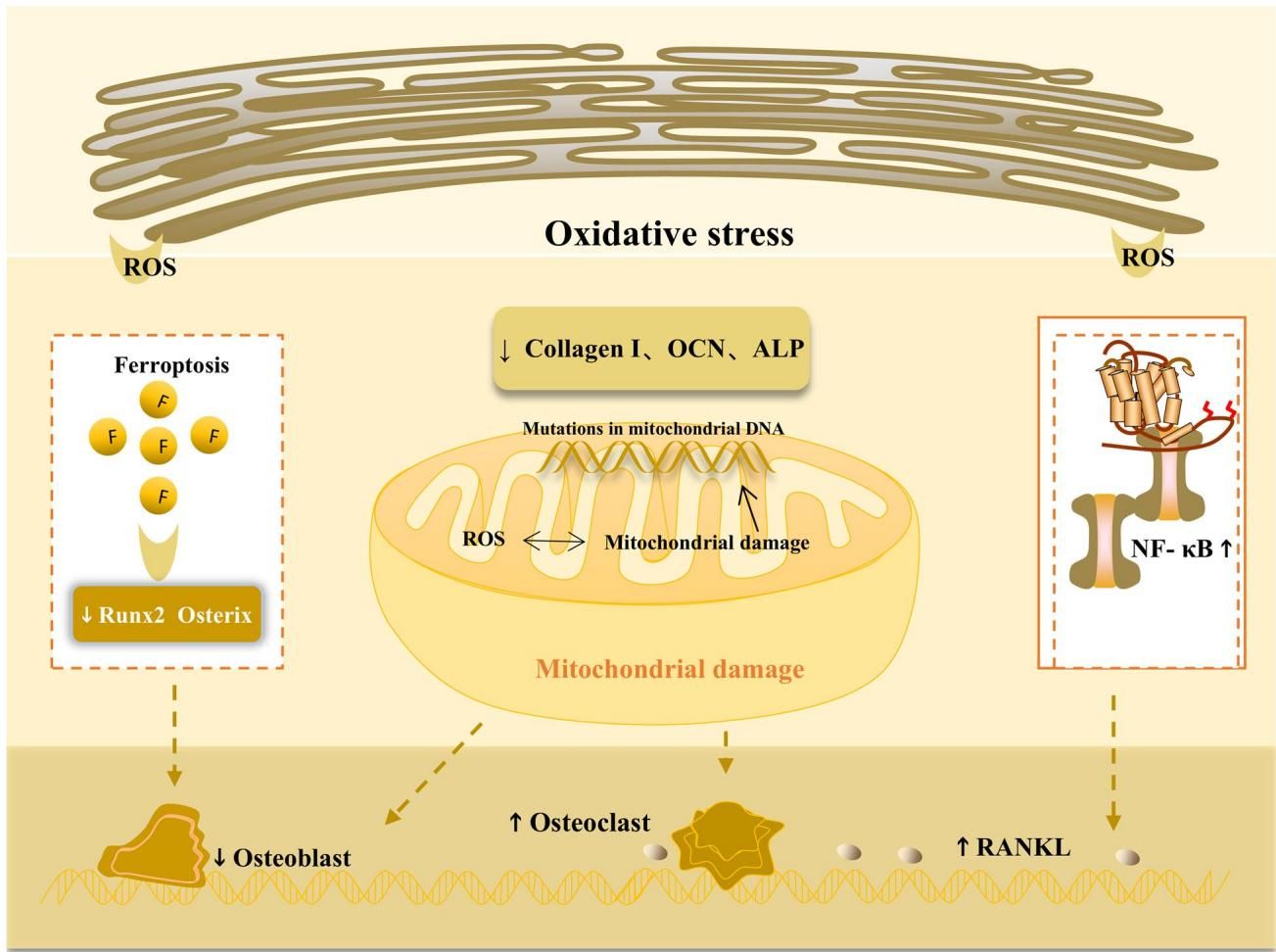
铁是人体必需的微量元素,但“过犹不及”。铁过载会导致细胞内脂质过氧化物堆积,触发铁死亡。如图[3]所示,氧化应激构成了骨质疏松病理图谱的背景。过量的 ROS(图[3]上方)导致胶原蛋白(Collagen I)、骨钙素(OCN)和碱性磷酸酶(ALP)水平下降,削弱了成骨能力。更关键的是,图[3]左侧展示了铁死亡过程如何直接导致成骨细胞及其前体细胞的死亡;而中间部分则描绘了线粒体受损后,ROS 的大量释放形成恶性循环,进一步激活右侧的 NF-κB 信号,最终导致破骨细胞活性增强(图[3]下方)。这种由铁代谢紊乱引发的“骨骼锈蚀”,正在成为治疗研究的新靶点 。
2.3 “骨免疫学”:免疫系统的倒戈
骨骼与免疫系统之间存在着一种令人意想不到的紧密联系,这一领域被称为“骨免疫学”(Osteoimmunology)。它们共享许多调节分子,其中最著名的便是 RANKL——它是连接骨骼与免疫系统的核心枢纽。在炎症状态下(如类风湿性关节炎或绝经后激素水平波动),免疫系统会“倒戈”攻击骨骼。
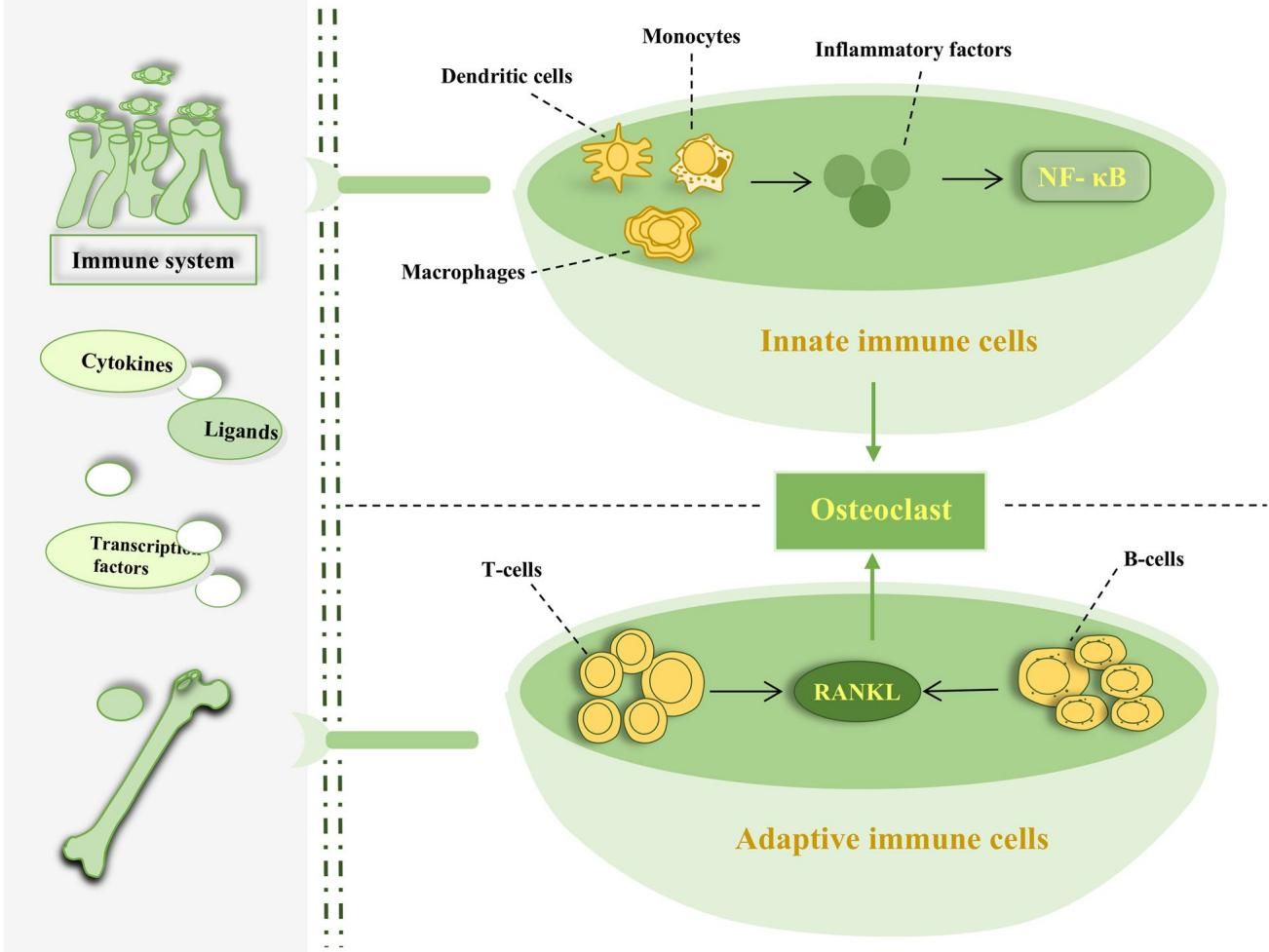
如图[4]所示,免疫系统中的各类细胞都参与了这一破坏过程。先天免疫细胞(图[4]上半部分),如树突状细胞和巨噬细胞,在炎性因子的刺激下,通过 NF-κB 通路被激活,直接促进破骨细胞的形成。而适应性免疫细胞(图[4]下半部分)也不甘示弱,活化的 T 细胞和 B 细胞会大量分泌 RANKL,这就像是给破骨细胞递送了“弹药”,极大地增强了其骨吸收能力。这就是为什么慢性炎症患者往往伴随着严重的骨质流失。
2.4 肠道菌群:被忽视的“第二基因组”
更令人惊讶的是,远在腹腔的肠道菌群竟然也能通过“肠-骨轴”遥控骨骼健康。肠道微生物不仅调节钙、维生素D等营养物质的吸收,还能影响雌激素的代谢。当肠道菌群失调时,肠道屏障受损,细菌毒素入血引发全身性炎症,刺激 Th17 细胞分泌 IL-17 等因子,进而激活破骨细胞。反之,益生菌代谢产生的短链脂肪酸(SCFAs)则能促进成骨,为骨骼提供保护 。
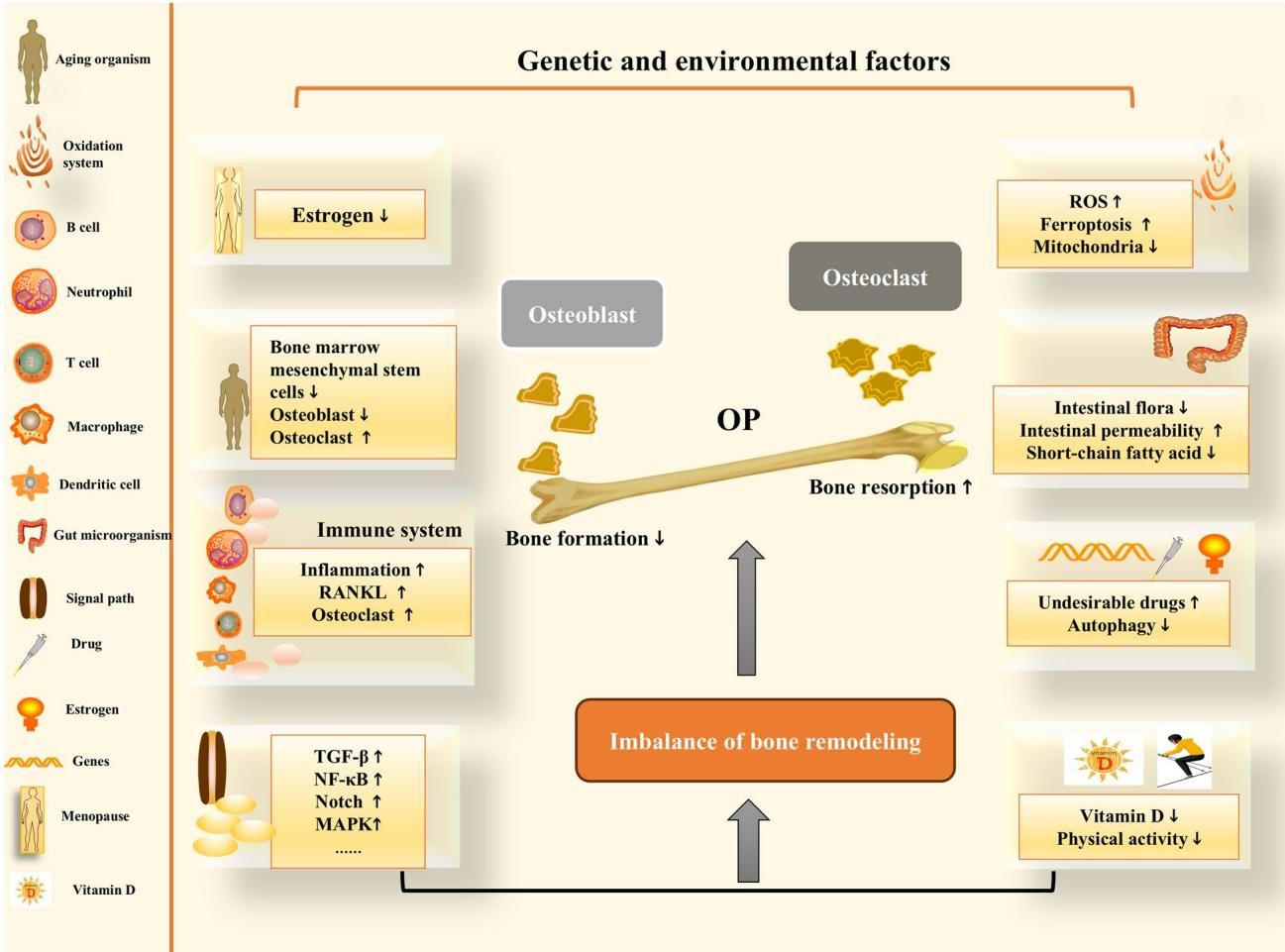
综上所述,骨质疏松绝非单一因素所致,而是基因、衰老、免疫炎症、氧化应激及肠道微生态等多重因素交织的复杂后果。正如总结图[5]所描绘的宏大图景:左侧列出了从衰老机体到基因、环境的各类风险因子;它们通过中间错综复杂的机制网络——雌激素下降、ROS 升高、铁死亡增加、免疫炎症风暴以及肠道菌群紊乱——最终汇聚成一个共同的结局:成骨细胞(Osteoblast)功能衰退,破骨细胞(Osteoclast)异常活跃,导致“骨重塑失衡”(Imbalance of bone remodeling),推倒了骨质疏松(OP)的多米诺骨牌。
3. 治疗新局:从压制到修复
面对如此复杂的机制,临床治疗也在不断进化。目前的干预策略大致可分为西医药物治疗、中医草本调理、生活方式管理以及新兴的前沿疗法。
3.1 西医治疗:精准打击与双刃剑
西医药物是目前临床治疗的主力军,主要分为三大类:
- 抗骨吸收药物:如双膦酸盐(阿伦磷酸钠、唑来膦酸等)和 RANKL 抑制剂(狄诺塞麦)。它们能强效抑制破骨细胞,像“刹车”一样减缓骨流失。但也存在副作用,如双膦酸盐可能导致长期服药者的颌骨坏死或非典型股骨骨折 [[text]]。
- 促骨形成药物:如甲状旁腺激素类似物(特立帕肽、阿巴洛帕肽)。这类药物能像“油门”一样直接刺激成骨细胞,增加骨量。但它们价格昂贵,且需每日注射,患者依从性较差。
- 双重作用药物:如硬骨素抑制剂(罗莫索珠单抗),它既能促进骨形成又能抑制骨吸收,效果显著,但需警惕潜在的心血管风险 [[text]]。
3.2 中医药:多靶点调和的智慧
与西药的“单点打击”不同,中医药强调多靶点、整体调节。近年来,大量研究证实了中草药在抗骨质疏松方面的潜力。例如:
- 淫羊藿:其主要成分淫羊藿苷(Icariin)能抑制 NF-κB 通路,减少 RANKL 分泌,同时促进成骨 [[text]]。
- 补骨脂与蛇床子:不仅能抗炎,还能调节 Wnt/β-catenin 通路,增强骨强度 [[text]][[text]]。
- 葛根与人参:通过调节肠道菌群和短链脂肪酸,修复“肠-骨轴”,间接保护骨骼 [[text]][[text]]。
中药通常副作用较小,且能改善患者的全身症状。如金天格胶囊(含人工虎骨粉)已在临床广泛应用,被证实能有效提升骨密度并缓解疼痛 [[text]]。但中医药也面临挑战:有效成分的生物利用度低、作用机制不够明确、缺乏高质量的国际化临床数据等。
3.3 未来已来:干细胞与黑科技
除了传统药物,一些极具科幻色彩的新兴疗法正蓄势待发。如图[6]所示,这些策略主要包括:
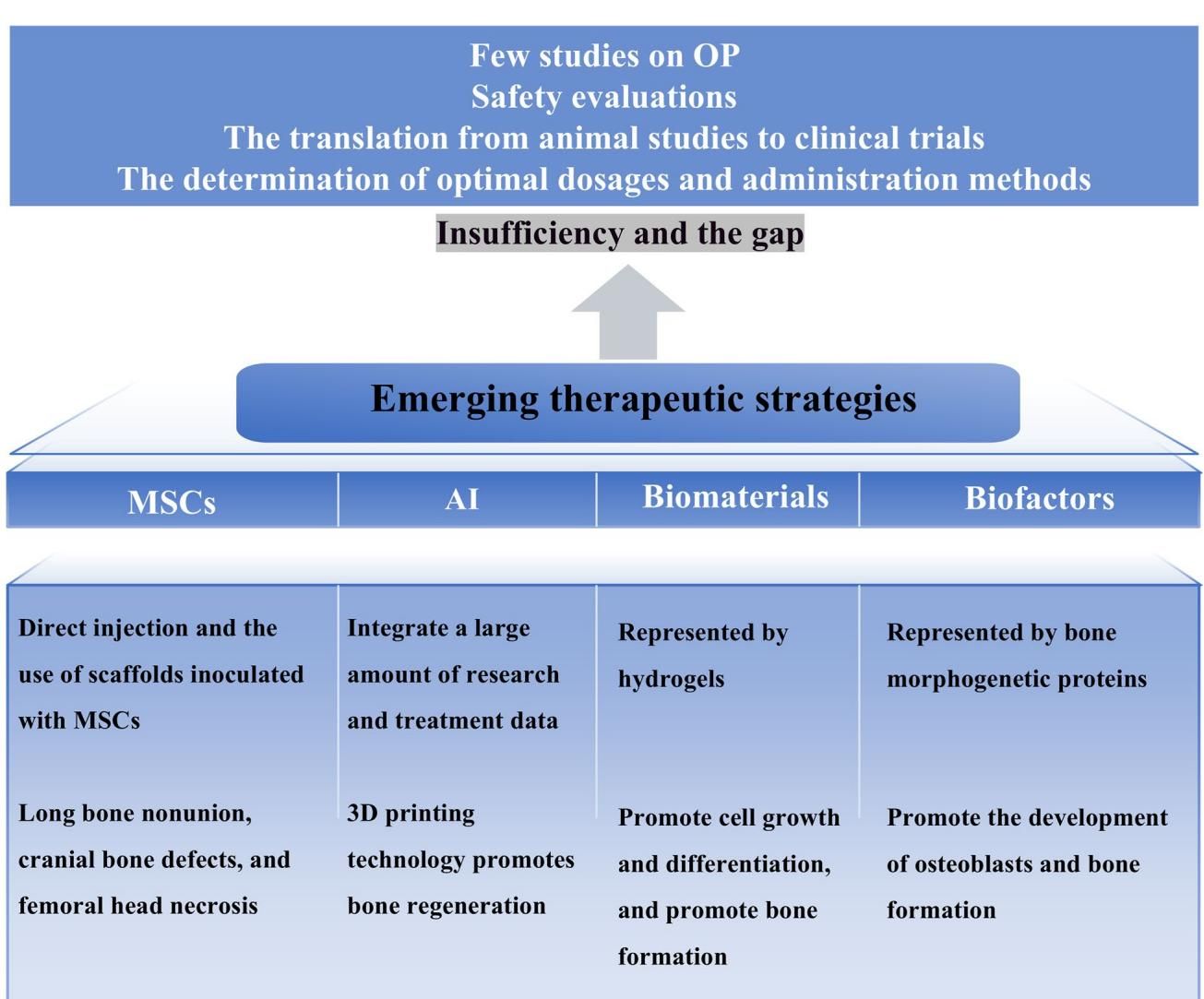
- 间充质干细胞(MSCs):具有自我更新和多向分化潜能,能直接分化为成骨细胞,并调节免疫微环境。虽然目前多用于骨折愈合,但其治疗全身性骨质疏松的潜力巨大 [[text]]。
- 生物材料与生物因子:如装载了骨形态发生蛋白(BMPs)的水凝胶支架,能为骨再生提供良好的物理和生化环境 [[text]]。
- 人工智能(AI):AI 技术正在辅助药物筛选、骨折风险预测以及 3D 打印个性化骨植入物等方面发挥越来越重要的作用 [[text]]。
然而,正如从图[6]顶部的箭头所指出的,这些新兴疗法距离临床普及仍有一段距离(Sufficiency and the gap)。目前仍缺乏针对骨质疏松的专项临床研究,且最佳剂量、给药方式及长期安全性评估(Safety evaluations)等问题亟待解决。
4. 结语
骨质疏松症的防治是一场持久战。从微观分子的基因甲基化、线粒体损伤,到宏观的免疫系统、肠道菌群,我们对它的认知正变得前所未有的清晰。未来的治疗将不再局限于单一的“补钙”或“止损”,而是走向中西医结合、精准靶向与再生修复并举的综合诊疗时代。对于大众而言,均衡饮食、适度运动(尤其是负重运动)、戒烟限酒以及定期的骨密度检查,依然是守护骨骼健康最坚实的基石。
论文信息
- 标题:Osteoporosis: molecular pathogenesis and therapeutic interventions.
- 论文链接:https://doi.org/10.1186/s43556-025-00349-5
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-11-5
- 期刊/会议:Molecular biomedicine
- 作者:Xubin Zhang, Yongsheng Liang, Fayao Zhang, Xiaoyuan Liu
本文由超能文献AI辅助创作,内容仅供学术交流参考,不代表任何医学建议。
References
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/uk1knsg168yeq0lwk004zgyu_1_cd40bab3e9.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/uk1knsg168yeq0lwk004zgyu_2_0ed25ed15f.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/uk1knsg168yeq0lwk004zgyu_3_b762c8a6f4.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/uk1knsg168yeq0lwk004zgyu_4_9cf129cdcf.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/uk1knsg168yeq0lwk004zgyu_5_558b3a0f2c.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/uk1knsg168yeq0lwk004zgyu_6_6b8a9892ad.jpg
分享
推荐阅读

从新冠到流感:mRNA疫苗技术的下一个战场
在近两万人参与的严格对照试验中,mRNA流感疫苗展示了比传统疫苗更优的保护效果。但更高的副作用发生率和对B型流感的"偏科",揭示了这项技术走向大规模应用前仍需跨越的障碍。

你的身体在44岁和60岁经历了什么?Stanford研究揭示衰老的两次"地震"
Stanford Medicine追踪108人数年,分析13.5万种分子,发现衰老并非匀速过程,而是在44岁和60岁出现两次剧烈波动,心血管、代谢、免疫系统均受影响。

儿童功能性便秘的“用药迷宫”:柳叶刀最新研究揭示谁才是真正的“通关钥匙”
柳叶刀最新研究揭示,聚乙二醇(PEG)在儿童功能性便秘治疗中,无论疗效还是安全性,均优于其他药物,是当之无愧的一线首选。

CAR-T 疗法治愈狼疮?癌症疗法转战自身免疫病的突破
2024年NEJM发表重磅研究:德国团队用CAR-T细胞疗法治疗15名重症自身免疫病患者,100%达到缓解。从癌症到狼疮,这场医学革命正在改写千万患者的命运。

10亿肥胖患者的"救命药",WHO开了绿灯却标上天价
2025年12月1日,世卫组织发布首个GLP-1药物治疗肥胖指南,覆盖司美格鲁肽等三大药物。但年费用上万美元,2030年仅10%患者可及,药企与医保的博弈才刚开始。