
告别终身服药?抗PD-1抗体Budigalimab为HIV“功能性治愈”带来新曙光
自1996年抗逆转录病毒疗法(ART)问世以来,艾滋病(HIV-1)已从一种绝症转变为一种可控的慢性疾病。对于全球数千万感染者而言,ART药物就像是维持生命的空气,一旦开始,便难以停歇。然而,这种“终身监禁”式的治疗方案并非完美的解药:病毒并未被彻底清除,而是潜伏在体内的“蓄水池”中;长期服药带来的副作用、药物相互作用以及伴随终身的污名化心理负担,始终是悬在患者头顶的达摩克里斯之剑。更重要的是,长期的慢性感染会导致免疫系统“精疲力竭”,T细胞功能受损,无法有效识别和清除残留的病毒。
如何打破这一僵局,实现无需每日服药的“功能性治愈”?科学家们将目光投向了肿瘤免疫治疗领域的明星分子——PD-1。PD-1是一种主要表达在T细胞表面的免疫检查点蛋白,在慢性HIV感染中,它就像是刹车片,抑制了T细胞的杀毒活性。近期,一篇发表在《Nature Medicine》上的重磅研究为我们展示了一种极具潜力的新策略:通过注射抗PD-1抗体Budigalimab,有望逆转免疫耗竭,帮助患者在停药后依然能控制病毒复制。
1. 唤醒“沉睡”的免疫卫士:从肿瘤到HIV的跨界尝试
人体内的CD8+ T细胞本应是查杀病毒的特种兵,但在长期的HIV感染抗衡中,这些细胞表面会异常高表达PD-1蛋白,导致它们进入一种“耗竭”状态,对病毒视而不见。理论上,如果我们能阻断PD-1与其配体的结合,就能松开免疫系统的刹车,恢复T细胞的战斗力。
基于这一理念,来自艾伯维(AbbVie)及其合作机构的研究团队开展了一项名为M19-939的随机、安慰剂对照、双盲1b期临床试验,旨在评估名为Budigalimab的研究性抗PD-1单克隆抗体在HIV感染者中的安全性与疗效。与肿瘤治疗中追求“火力全开”的高剂量不同,本研究创新性地采用了低剂量策略,试图在激活抗HIV免疫反应的同时,最大程度减少自身免疫副作用的风险。
2. 精准剂量的探索:以更低的代价换取免疫激活
这项研究设计十分严谨,招募了41名正在接受ART治疗且病毒得到有效抑制的HIV感染者。试验分为两个阶段:第一阶段测试了每4周一次的2mg或10mg剂量;第二阶段则进一步优化,采用了每2周一次(Q2W)的10mg剂量,共注射4次。为了验证药物是否真的起效,研究采用了一个大胆但必要的步骤——“分析性治疗中断”(ATI),即在严密监控下让志愿者暂停服用抗病毒药物,观察体内病毒是否反弹。
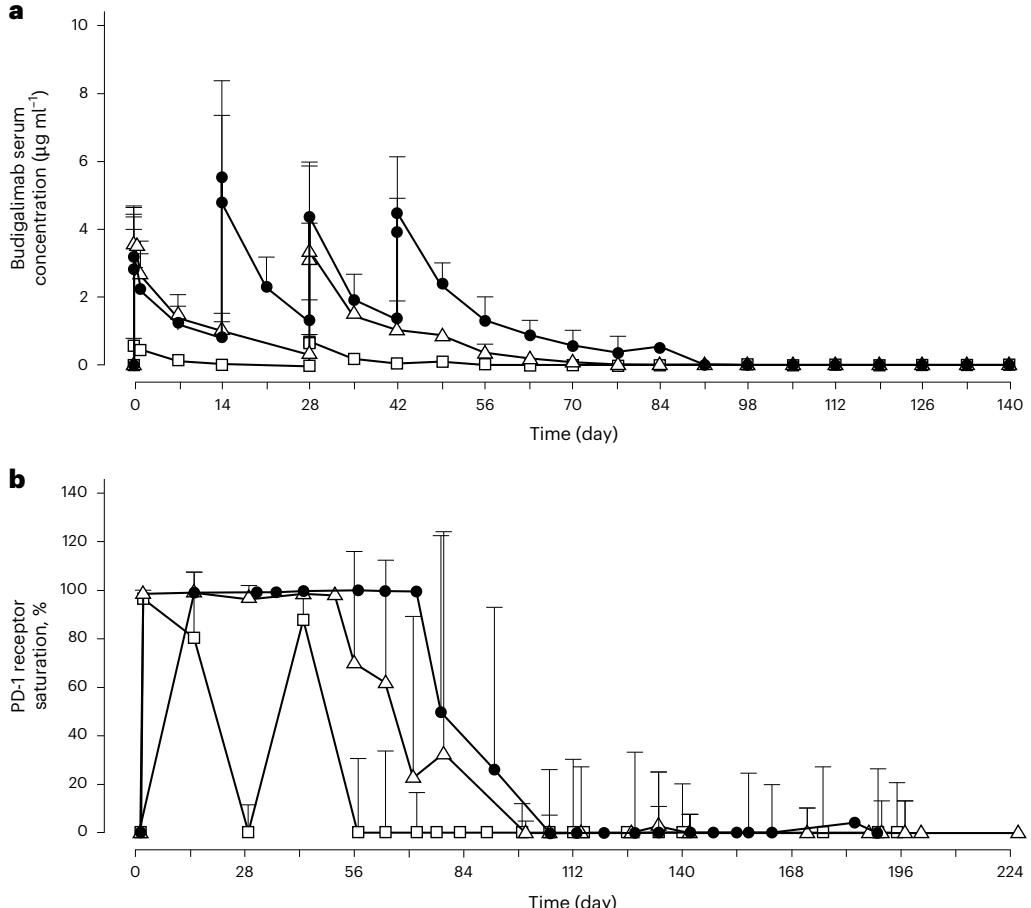
药物在体内的表现如何?药代动力学数据给出了积极的反馈。如图[1]所示,研究人员对比了不同剂量下的血清药物浓度与靶点占有率。从图[1]a的血清浓度曲线可以清晰地看到,虽然2mg低剂量组(空心方块)的药物代谢较快,但10mg组(实心圆点和三角形)能够维持较高的药物暴露水平。更关键的信息来自于图[1]b的PD-1受体饱和度分析:10mg Q2W的给药方案(实心圆点)使得外周血CD8+ T细胞上的PD-1受体饱和度在最后一次给药后,依然能维持在近乎完全饱和(>95%)的状态长达约10周。这意味着,该剂量足以在相当长的一段时间内持续“松开刹车”,为免疫系统创造反击的窗口期,同时避免了肿瘤治疗中高剂量带来的过高风险。
3. 令人振奋的疗效信号:部分患者实现长达数月的“无药控制”
当药物成功“占领”了PD-1受体后,真实的抗病毒效果究竟如何?这是所有人都屏息以待的结果。在第二阶段接受10mg Q2W剂量治疗的11名参与者中,研究人员观察到了令人鼓舞的现象。
通常情况下,HIV感染者一旦停止ART药物,体内的病毒载量会在2-4周内迅速飙升。然而,在本研究的治疗组中,病毒反弹的模式发生了改变。如图[2]所示,展示了不同组别在停止ART药物后的病毒载量变化轨迹。请注意图[2]c(紫色和黑色线条),这是接受了四周10mg Budigalimab治疗的受试者数据。与图[2]d中迅速反弹且峰值极高的安慰剂组(灰色线条)形成鲜明对比,治疗组中有6名参与者(超过半数)表现出了显著的病毒控制能力:

- 延迟反弹:病毒卷土重来的时间被明显推后。
- 低病毒峰值:即便病毒反弹,其最高载量也远低于通常水平。
- 持久控制:最为惊人的是,有2名参与者(图[2]c中贴近底部的黑线)在整个研究期间完全不需要重新启动ART治疗,他们分别在停药后维持了长达204天和252天的无药病毒控制状态,且病毒载量始终低于200拷贝/毫升。这种现象在非自然控制者人群中是极其罕见的。
这一结果不仅仅是数字上的差异,它有力地证明了通过PD-1阻断剂逆转免疫耗竭,确实有可能帮助部分患者重获对病毒的免疫控制力,哪怕只是暂时的,也向着“功能性治愈”迈出了坚实的一步。
4. 安全性与未来展望
除了疗效,安全性是此类免疫疗法能否普及的关键。在肿瘤治疗中,PD-1抑制剂常伴随着严重的免疫相关不良事件(IRAEs)。幸运的是,得益于本研究精心设计的低剂量短程方案,Budigalimab表现出了良好的耐受性。在41名参与者中,仅有2例发生了轻度(1级)的免疫相关不良事件(甲状腺炎和甲状腺功能亢进),且均为可逆。没有出现与治疗相关的严重不良事件或死亡,这为后续更大规模的临床试验奠定了安全基础。
尽管目前的研究样本量较小,且并未所有受试者都对药物产生了积极响应,但这项1b期研究无疑点亮了一盏明灯。它证实了低剂量抗PD-1抗体在HIV治疗中的可行性,并提示我们,通过免疫调节来打破HIV的终身服药魔咒并非天方夜谭。目前,更大规模的2期临床试验正在进行中,甚至包括了与其他免疫疗法(如抗α4β7抗体)的联合使用,我们有理由期待,在不远的将来,HIV感染者能迎来一个无需每日服药的新时代。
论文信息
- 标题:Budigalimab, an anti-PD-1 inhibitor, for people living with HIV-1: a randomized, placebo-controlled phase 1b study.
- 论文链接:https://doi.org/10.1038/s41591-025-03993-0
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-11
- 期刊/会议:Nature medicine
- 作者:Moti N Ramgopal, Jacob P Lalezari, Ana Gabriela Pires Dos Santos, ..., Jean-Pierre Routy
本文由超能文献AI辅助创作,内容仅供学术交流参考,不代表任何医学建议。
References
分享
推荐阅读

10亿肥胖患者的"救命药",WHO开了绿灯却标上天价
2025年12月1日,世卫组织发布首个GLP-1药物治疗肥胖指南,覆盖司美格鲁肽等三大药物。但年费用上万美元,2030年仅10%患者可及,药企与医保的博弈才刚开始。

21天闯关成功:创新药"30日通道"首例获批,中国药审驶入快车道

CAR-T 疗法治愈狼疮?癌症疗法转战自身免疫病的突破
2024年NEJM发表重磅研究:德国团队用CAR-T细胞疗法治疗15名重症自身免疫病患者,100%达到缓解。从癌症到狼疮,这场医学革命正在改写千万患者的命运。

Nature Medicine重磅:一次输注,长期治愈?中国血友病B基因疗法交出亮眼答卷
中国医学科学院血液病医院张磊教授团队与Belief Biomed合作,在《Nature Medicine》发表血友病B基因疗法BBM-H901的I/II及III期临床成果,显示一次输注显著降低出血率,提升凝血因子活性,有望实现长期治愈。

FDA移除更年期激素疗法"黑框警告":20年争议终结,还是新风险开始?
FDA于2025年11月10日移除更年期激素替代疗法黑框警告,结束20年争议。深度解读WHI研究误读、政策反转逻辑与全球1.2亿女性的健康选择。

MIT开源BoltzGen:AI设计蛋白质药物,向"不可成药"靶点宣战
MIT团队推出开源AI模型BoltzGen,在26个挑战性靶点上实现纳摩尔级结合亲和力,67%成功率打破蛋白质设计困境,免费商用或颠覆制药行业格局。

超加工食品的全球警报:《柳叶刀》揭示人类健康的隐形杀手
覆盖104项研究的综合分析显示,92%的研究证实超加工食品与慢性病相关。这场由跨国食品公司主导的饮食革命,正在成为21世纪最严重的公共卫生威胁之一。

CRISPR"隐形"细胞:糖尿病患者6个月不打胰岛素
2024年12月,一名1型糖尿病患者接受了经过CRISPR编辑的供体胰岛细胞移植。六个月后,这些细胞依然在他手臂肌肉里稳定工作,无需任何免疫抑制药物。这是细胞治疗领域的分水岭时刻。

Nature Med: 地中海饮食是APOE4基因“克星”,逆转代谢劣势预防痴呆
哈佛34年追踪研究揭示,地中海饮食对高风险APOE4纯合子携带者预防痴呆的保护作用最为显著,且通过调节特定代谢物实现。研究发现APOE4纯合子有独特的代谢指纹,地中海饮食能精准纠正其脂质代谢失调。孟德尔随机化证实4-GBA、类胡萝卜素和谷氨酰胺对痴呆有因果保护作用,为精准干预提供靶点。