
2022年秋季的流感季,美国、南非和菲律宾的242个医疗中心同时启动了一项不寻常的疫苗试验。18476名18-64岁的健康成年人被随机分配,一半人接种传统的灭活流感疫苗(赛诺菲的Fluzone),另一半则接种了一种全新的mRNA流感疫苗——这是新冠疫情期间大放异彩的mRNA技术,首次在流感疫苗领域进行大规模三期临床验证[1]。
11月19日,《新英格兰医学杂志》(NEJM)发表了这项代号为"C4781004"的试验结果:mRNA疫苗的相对保护效力达到34.5%,意味着接种者患流感样疾病的风险比传统疫苗组降低了三分之一以上。在mRNA疫苗组,只有57人出现实验室确诊的流感样疾病,而传统疫苗组则有87人——这是mRNA流感疫苗首次在头对头比较中证明自己的优越性[1]。
这个数字听起来或许不够"惊艳"。毕竟,新冠mRNA疫苗在临床试验中曾展现出超过90%的绝对保护效力。但流感疫苗从来就不是一个"简单"的对手。
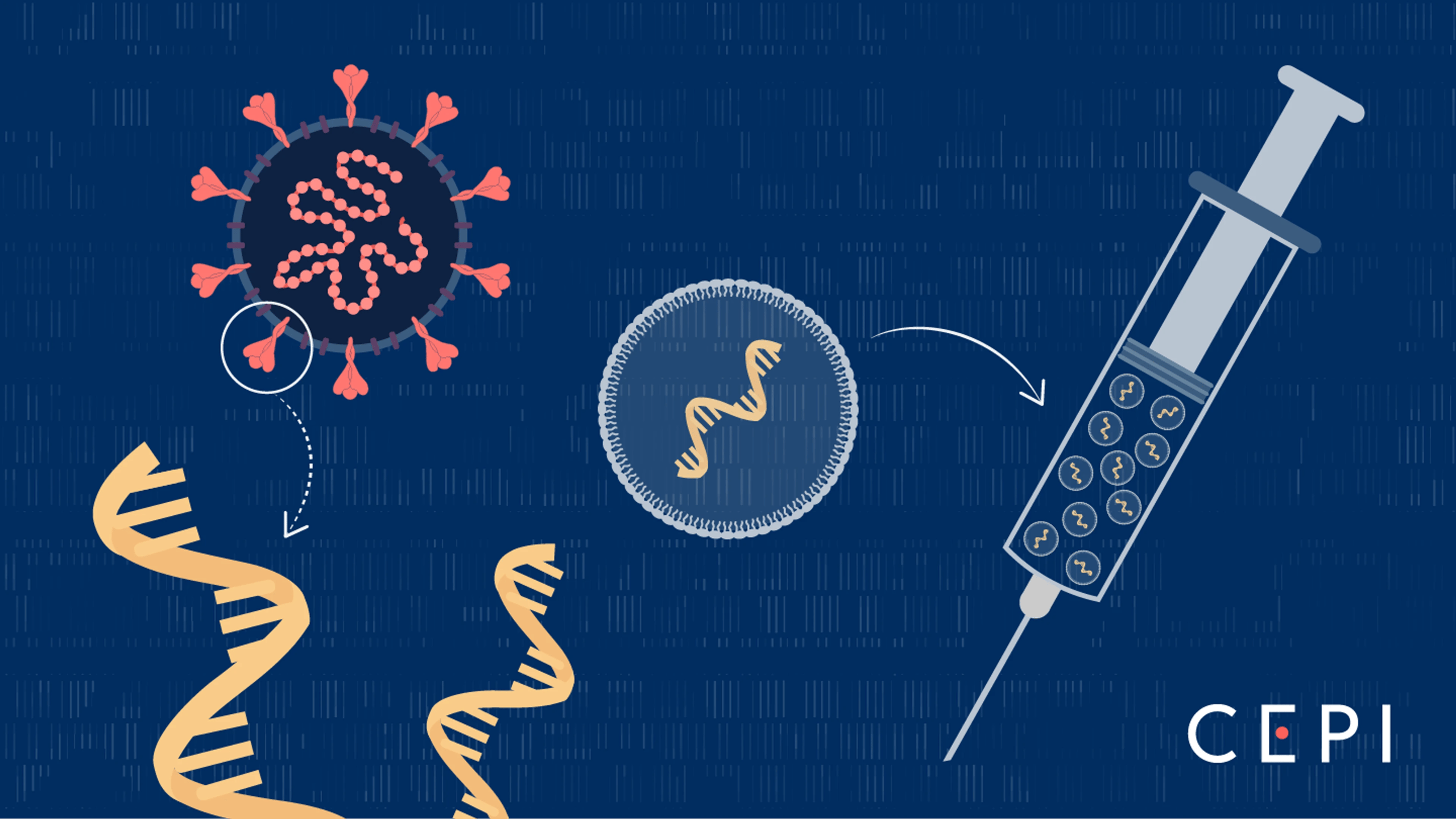 图1:mRNA疫苗通过脂质纳米颗粒将遗传指令送入细胞,让细胞自己生产病毒抗原,从而激发免疫反应。来源:CEPI
图1:mRNA疫苗通过脂质纳米颗粒将遗传指令送入细胞,让细胞自己生产病毒抗原,从而激发免疫反应。来源:CEPI
流感病毒是自然界最"狡猾"的病原体之一。它的表面覆盖着两种关键蛋白质:血凝素(Hemagglutinin,HA)和神经氨酸酶(Neuraminidase,NA)。血凝素就像病毒的"万能钥匙",帮助它撬开人类细胞的大门;而神经氨酸酶则像"逃生梯",帮助新生病毒从被感染的细胞中释放出来。问题在于,流感病毒拥有18种不同亚型的HA和11种不同亚型的NA——理论上可以组合出198种流感病毒。更糟糕的是,这些蛋白质的基因极不稳定,每年都会发生"漂移"突变,有时甚至会发生大规模的"移位"重组,产生全新的病毒株[2]。
这种"百变"特性让流感疫苗陷入了永恒的追赶游戏。每年2月,世界卫生组织(WHO)的专家们都要预测下一个冬季可能流行的流感毒株,然后疫苗生产商争分夺秒地培养这些病毒、提取抗原、生产疫苗。整个过程通常需要6个月,而且依赖于在数百万枚鸡蛋中培养病毒——这项技术自1940年代以来基本没有改变。更麻烦的是,病毒在鸡蛋中生长时,常常会发生"蛋适应性突变"(egg-adaptive mutations),导致疫苗抗原与实际流行的病毒"对不上号",疫苗效力因此大打折扣[3]。
根据美国疾病控制与预防中心(CDC)的数据,从2004年到2023年的19个流感季中,传统流感疫苗的整体有效性在10%到60%之间波动——平均只有40%左右。在2022-2023年这个试验所在的流感季,美国许可的流感疫苗对18-64岁人群的保护效力估计为44-54%[1]。换句话说,即使接种了疫苗,你仍有不小的几率中招。
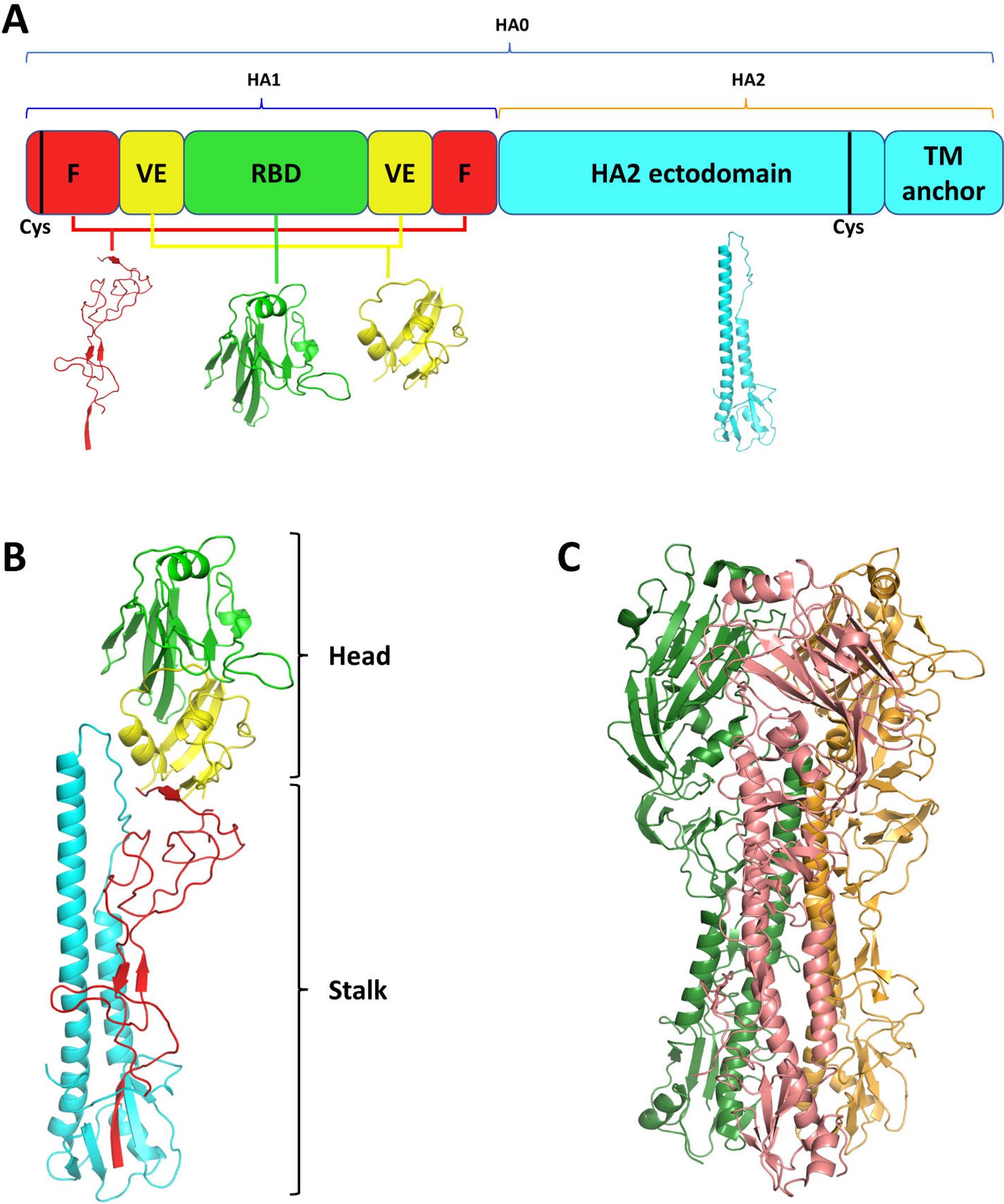 图2:流感病毒表面的血凝素蛋白呈三聚体结构,是疫苗设计的主要靶标。其高度变异性是流感疫苗效力不稳定的根源。来源:Nature Communications
图2:流感病毒表面的血凝素蛋白呈三聚体结构,是疫苗设计的主要靶标。其高度变异性是流感疫苗效力不稳定的根源。来源:Nature Communications
mRNA疫苗技术的出现,被寄予了打破这一困局的希望。它的核心逻辑优雅而简洁:不再需要培养病毒、提取蛋白,而是直接合成一段"遗传指令"(修饰核苷mRNA),将其包裹在脂质纳米颗粒中注射进人体。这些纳米颗粒像特洛伊木马一样进入肌肉细胞,释放出mRNA分子。细胞的核糖体读取这些指令,开始生产流感病毒的血凝素蛋白——但仅仅是蛋白质片段,不包含任何病毒遗传物质,因此完全无害。免疫系统识别到这些"外来"蛋白,开始训练B细胞产生抗体,同时激活T细胞建立细胞免疫记忆[4]。
这项技术有三大潜在优势。第一,生产速度快。从获得病毒基因序列到生产出疫苗,理论上只需要几周时间——不再需要漫长的病毒培养过程。第二,精准匹配。由于直接根据基因序列合成mRNA,不存在"蛋适应性突变"的问题,疫苗抗原可以完美匹配实际流行的病毒株。第三,容易规模化。mRNA疫苗的生产平台是通用的,只需要更换序列"模板",同一条生产线就能生产不同疫苗[3]。
新冠疫情为mRNA技术提供了"实战演练"的机会。辉瑞-BioNTech和Moderna的mRNA新冠疫苗在全球接种了数十亿剂,证明了这项技术的安全性和有效性。但流感疫苗是一个更复杂的挑战:新冠疫苗只需要针对一种病毒的一个抗原(刺突蛋白),而四价流感疫苗需要同时编码四种不同病毒株的血凝素——两种甲型流感(A/H3N2和A/H1N1)和两种乙型流感(B/Yamagata和B/Victoria)。这意味着mRNA分子要更长、更复杂,生产和质控的难度也更大[1]。
辉瑞的研究团队在设计疫苗时,选择了一种"修饰核苷mRNA"(modRNA)技术。他们用假尿苷(pseudouridine)等修饰核苷替代了部分天然核苷,这样可以降低mRNA引发的先天免疫激活(避免疫苗被当成"病毒入侵"而过早降解),同时提高蛋白质翻译效率。每剂疫苗含有30微克mRNA,分别编码2022-2023北半球流感季WHO推荐的四个毒株的血凝素[1]。
 图3:严格设计的临床三期试验是验证疫苗有效性和安全性的黄金标准。来源:OHSU
图3:严格设计的临床三期试验是验证疫苗有效性和安全性的黄金标准。来源:OHSU
试验的设计非常严格。18476名参与者被随机分配到两组,既不知道自己接种的是哪种疫苗,负责评估症状和检测病毒的研究人员也不知道——这叫做"双盲对照"。参与者需要在出现流感样症状(发烧、咳嗽、喉咙痛等)时立即联系研究团队,进行鼻咽拭子采样。只有通过PCR检测确认感染了流感病毒,才算一例"实验室确诊的流感样疾病"[1]。
2022-2023年的流感季由A/H3N2主导,其次是A/H1N1,几乎没有乙型流感流行——这为试验提供了天然的"压力测试"环境。最终,mRNA疫苗在主要终点上达到了"非劣效性"(不比对照疫苗差)和"优效性"(显著优于对照疫苗)两个标准。相对保护效力34.5%,意味着如果传统疫苗能让44-54%的人免于感染,那么mRNA疫苗能保护的人数则上升到60-67%[1]。
免疫原性数据进一步印证了这一结果。研究人员在约4000名参与者中采集了血样,检测血凝素抑制(HAI)抗体滴度——这是评估流感疫苗免疫反应的"金标准"。结果显示,对于A/H3N2和A/H1N1两种甲型流感,mRNA疫苗诱导的抗体滴度显著高于传统疫苗,而且"血清转换率"(接种后抗体显著升高的人群比例)也更高。但对于两种乙型流感,mRNA疫苗的表现却不尽如人意——抗体水平反而低于传统疫苗[1]。
这种"偏科"现象令研究人员困惑。理论上,mRNA疫苗对四种毒株应该一视同仁。一种可能的解释是,乙型流感的血凝素蛋白在结构上与甲型流感差异较大,其mRNA序列可能在细胞内的翻译效率较低,或者产生的蛋白构象不够理想。另一种可能是,传统的HAI检测方法对乙型流感不够敏感——以往研究就发现,HAI抗体滴度与乙型流感实际保护力的相关性不如甲型流感那么强[5]。由于试验期间几乎没有乙型流感病例,研究人员无法直接验证mRNA疫苗对乙型流感的保护效果。这成为这项研究的一个重要局限。
另一个不容忽视的问题是副作用。在约6000名被要求记录副作用的参与者中,mRNA疫苗组报告局部反应(注射部位疼痛、红肿等)的比例为70.1%,而传统疫苗组只有43.1%;全身反应(疲劳、头痛、肌肉酸痛等)的比例分别为65.8%和48.7%。发烧在mRNA疫苗组出现的频率是5.6%,传统疫苗组只有1.7%[1]。
好消息是,绝大多数副作用都是轻度到中度的,持续时间通常只有1-2天,没有出现严重安全事件。这与新冠mRNA疫苗的经验一致:更强的免疫激活往往伴随更明显的反应原性——这实际上是免疫系统"正在工作"的信号。但从公共卫生角度看,这种差异可能影响疫苗的接受度。流感疫苗不像新冠疫苗那样有"刚需"属性,如果接种后不适感太强,一些人可能会选择放弃[1]。
从产业视角看,这项试验为mRNA流感疫苗的商业化铺平了道路。全球流感疫苗市场规模约为60-80亿美元,其中四价疫苗是主流。如果mRNA疫苗能以更高的保护效力和更快的应变速度(面对新毒株时)争取到一定市场份额,对辉瑞和其他mRNA疫苗开发商来说将是一笔可观的收入。更重要的是,这证明了mRNA平台的"通用性"——同一套技术可以从新冠延伸到流感,未来还可能应用于呼吸道合胞病毒(RSV)、巨细胞病毒(CMV)等其他病原体[6]。
但要真正取代传统流感疫苗,mRNA技术还有几个关键问题待解。首先是成本。mRNA疫苗的生产虽然快,但原材料(脂质纳米颗粒、修饰核苷等)价格昂贵,目前的生产成本远高于传统疫苗。随着规模化和技术成熟,成本会下降,但能否降到与传统疫苗竞争的水平,还需时间验证。其次是储存和运输。mRNA分子在常温下不稳定,需要冷链运输(辉瑞的流感mRNA疫苗储存条件尚未公布,但新冠mRNA疫苗需要-20℃到-70℃),这在发展中国家和偏远地区是个挑战[6]。
再次是对乙型流感的"软肋"。如果未来某个流感季以乙型流感为主导,mRNA疫苗可能无法展现优势,甚至可能不如传统疫苗。研究人员需要优化乙型流感血凝素的mRNA序列和递送系统,才能实现"全能"保护。最后是长期免疫持久性。这项试验只追踪了6个月,而流感疫苗通常需要提供至少一个流感季(约半年)的保护。虽然抗体水平在6个月时仍然较高,但是否足以抵御感染,需要更长期的观察[1]。
值得注意的是,这项试验还检测了细胞免疫反应。在约125名参与者中,研究人员分析了CD4+和CD8+ T细胞对血凝素的反应。结果显示,mRNA疫苗激发的T细胞反应明显强于传统疫苗,尤其是CD8+ T细胞——这是一种能够直接杀伤感染细胞的"杀手T细胞"。传统的灭活疫苗几乎不诱导CD8+ T细胞反应,因为它们只含有病毒蛋白片段,无法进入细胞内部被免疫系统"看见"。而mRNA疫苗则让细胞"从内部"生产抗原,从而激活细胞免疫[1]。
这种细胞免疫优势可能在实际流行季中发挥重要作用。即使抗体不足以完全阻止病毒感染,强大的T细胞反应也能迅速清除感染细胞,缩短病程、减轻症状。这或许能解释为什么mRNA疫苗在抗体滴度只是"略高"的情况下,能展现出34.5%的相对效力提升。
从更宏观的角度看,这项研究标志着疫苗技术的一个历史性转折。流感疫苗的生产方法在过去80年里基本没有革命性变化——我们仍然依赖鸡蛋培养、病毒灭活、蛋白提纯这套"古老"工艺。mRNA技术第一次让我们有可能摆脱这套体系,建立一个更快速、更灵活、更可预测的疫苗生产模式。就像数字化取代胶片摄影一样,这可能是一场不可逆转的技术范式转移。
当然,任何新技术的普及都不会一帆风顺。传统疫苗生产商有着庞大的设施投资和成熟的供应链,不会轻易放弃市场。监管机构需要建立新的审评标准,来评估mRNA疫苗的质量和一致性。公众需要时间来接受这种"用基因技术制造疫苗"的概念,尤其是在反疫苗运动和疫苗犹豫情绪仍然存在的背景下。
但历史告诉我们,更好的技术最终会胜出。青霉素取代了磺胺,口服疫苗取代了注射脊髓灰质炎疫苗,mRNA流感疫苗也许会在未来十年内成为主流。这项发表在《新英格兰医学杂志》上的三期试验,就像一块投入湖面的石子,它激起的涟漪才刚刚开始扩散。
对于普通人来说,这意味着什么?在可预见的未来,你去接种流感疫苗时,可能会面临两个选择:传统的"鸡蛋疫苗"和新型的"mRNA疫苗"。后者可能保护效果更好,但副作用稍多,价格可能也更贵。如何选择?答案取决于你的风险评估:如果你属于流感高危人群(老年人、慢性病患者、医护人员),或者特别希望避免感染,mRNA疫苗可能是更好的选择;如果你身体健康、风险较低,而对副作用比较敏感,传统疫苗仍是不错的选项。
但有一点是确定的:无论哪种疫苗,都远远好过不接种。每年全球有超过50万人死于流感,数百万人因流感住院。在与这个"古老敌人"的战斗中,我们终于有了更强大的武器。
参考文献
[1] Fitz-Patrick, D., et al. (2025). Efficacy, Immunogenicity, and Safety of Modified mRNA Influenza Vaccine. New England Journal of Medicine. DOI: 10.1056/NEJMoa2416779. 发表时间:2025年11月19日。https://www.nejm.org/doi/full/10.1056/NEJMoa2416779
[2] Kim, H., Webster, R. G., & Webby, R. J. (2018). Influenza virus: dealing with a drifting and shifting pathogen. Viral Immunology, 31(2), 174-183.
[3] Hegde, N. R. (2015). Cell culture-based influenza vaccines: a necessary and indispensable investment for the future. Human Vaccines & Immunotherapeutics, 11(5), 1223-1234.
[4] Pardi, N., Hogan, M. J., Porter, F. W., & Weissman, D. (2018). mRNA vaccines—a new era in vaccinology. Nature Reviews Drug Discovery, 17(4), 261-279.
[5] Monto, A. S., & Maassab, H. F. (1981). Ether treatment of type B influenza virus antigen for the hemagglutination inhibition test. Journal of Clinical Microbiology, 13(1), 54-57.
[6] Branche, A., et al. (2025). A phase 1/2 randomized study to evaluate the safety, tolerability, and immunogenicity of nucleoside-modified messenger RNA influenza vaccines in healthy adults. Vaccines, 13(4), 383.
本文由超能文献团队发表 | 超能文献(https://suppr.wilddata.cn/)
分享