
胖而不病?Nature Medicine 重磅:科学家发现“健康肥胖”的基因密码,揭示8种基因决定的肥胖亚型
在公共卫生的宏大叙事中,肥胖通常被描绘成万病之源——它是心血管疾病、2型糖尿病和高血压的“头号嫌疑人”。这种基于体重指数(BMI)的单一维度认知,构成了我们对代谢健康理解的基石。
然而,临床观察中长期存在着一个令人费解的悖论: 并非所有肥胖者都会患上代谢疾病。我们身边总有一些“大码”朋友,尽管体脂率超标,体检报告上的血糖、血脂和血压数据却令人艳羡地保持在健康范围内;反之,一些体重正常的人却深受代谢紊乱的困扰。这种现象暗示了肥胖内部存在着巨大的异质性,即脂肪的积累与代谢并发症之间,似乎存在着某种可以被“解绑”的生物学机制。
究竟是什么基因力量,将多余的脂肪与糟糕的健康后果区分开来?
近日,来自西奈山伊坎医学院(Icahn School of Medicine at Mount Sinai)和哈佛-麻省理工博德研究所(Broad Institute)的科学家们在顶刊《Nature Medicine》上发表了一项里程碑式的研究。他们利用英国生物样本库(UK Biobank)中超过45万人的数据,通过极具创新性的“双性状”(bi-trait)分析方法,成功鉴定出266个能将肥胖与心脏代谢合并症“解耦”的基因变异。这项研究不仅从遗传学角度证实了“健康肥胖”的存在,更进一步将肥胖精细划分为8种不同的遗传亚型,为未来肥胖的精准治疗提供了全新的路线图。
1. 寻找“解耦”基因:当脂肪不再是敌
传统的全基因组关联分析(GWAS)往往只盯着单一的肥胖指标(如BMI)看。这种“一刀切”的方法虽然发现了上千个与肥胖相关的基因位点,但它混淆了导致肥胖的各种不同路径——有的基因让你吃得多,有的让你消耗少,而有的可能决定了你把脂肪存在哪里。为了突破这一局限,研究团队设计了一种巧妙的统计学策略。
他们并没有单纯地寻找导致肥胖的基因,而是寻找那些在增加体脂的同时,却能降低心血管代谢风险的基因变异。研究人员构建了24种“双性状”表型,简单来说,就是用肥胖指标(如BMI、体脂率BFP、腰臀比WHR)减去代谢指标(如胆固醇、血糖、血压)的标准化数值。通过这种加减法,他们筛选出了那些让个体“胖却健康”的特殊遗传标记。
如图[1]所示,这项研究的流程十分严谨。研究团队首先在超过45万名欧洲血统参与者中进行了全基因组筛选,针对3种肥胖特征和8种心脏代谢特征构建了“解耦表型”。
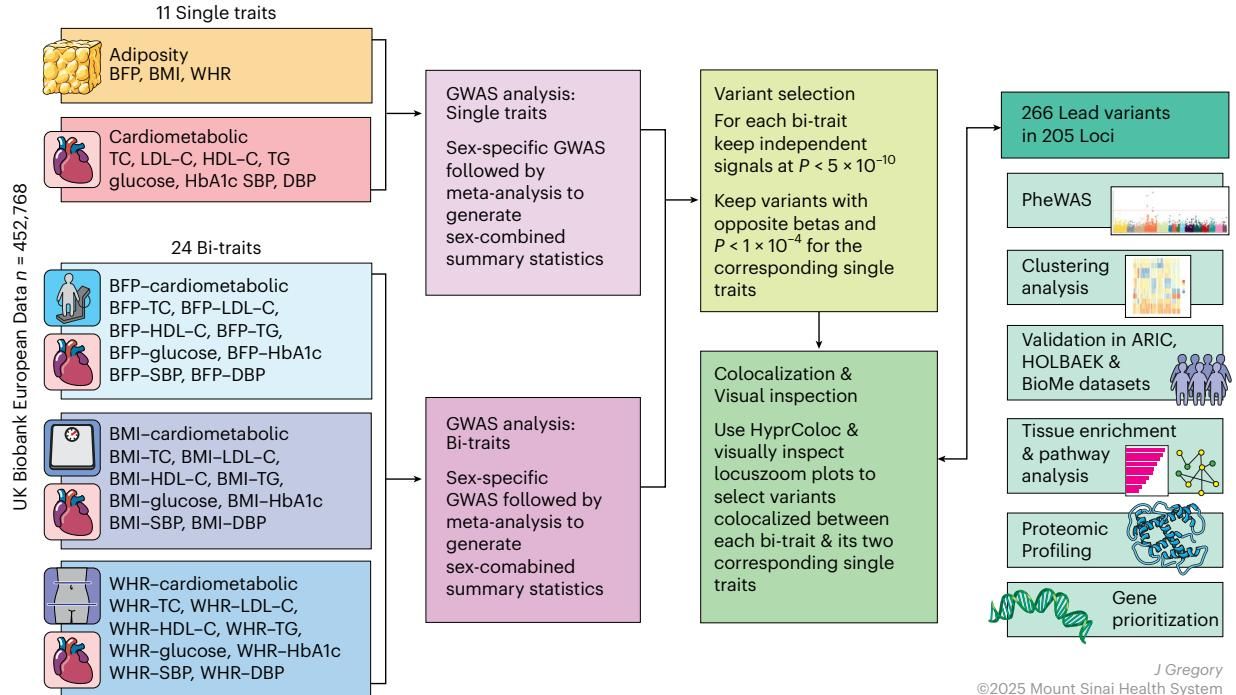
从图[1]的研究概览中我们可以清晰地看到,研究者通过对比分析,最终锁定了205个基因组位点上的266个独立变异。这些变异有一个共同的奇特属性:携带这些“增脂”等位基因的人,虽然体脂倾向于增加,但他们的高血压、糖尿病或血脂异常的风险反而降低了。 这就是所谓的“解耦”(Uncoupling)现象。
2. 两种命运:普通肥胖 vs. “解耦”肥胖
为了量化这种遗传效应,研究人员构建了一个特殊的遗传风险评分——解耦遗传风险评分(),并将其与代表普通肥胖风险的体脂率遗传评分()进行了全方位的对比。
数据分析揭示了一个截然不同的生物学图景。虽然这两个评分升高都意味着体脂率和BMI的增加,但它们对代谢健康的后续影响却分道扬镳:
- 普通肥胖评分()升高: 伴随着甘油三酯、糖化血红蛋白、血压的全面升高,以及“好胆固醇”(HDL-C)的降低。这符合我们对肥胖的传统认知。
- 解耦评分()升高: 尽管人变胖了,但他们的甘油三酯、低密度脂蛋白胆固醇(LDL-C)和血糖水平反而更低,“好胆固醇”水平更高,血压也控制得更好。
这种戏剧性的反差通过可视化数据得到了最直观的体现。如图[2]所示,研究人员展示了两种遗传评分与各项身体指标的关联强度雷达图。
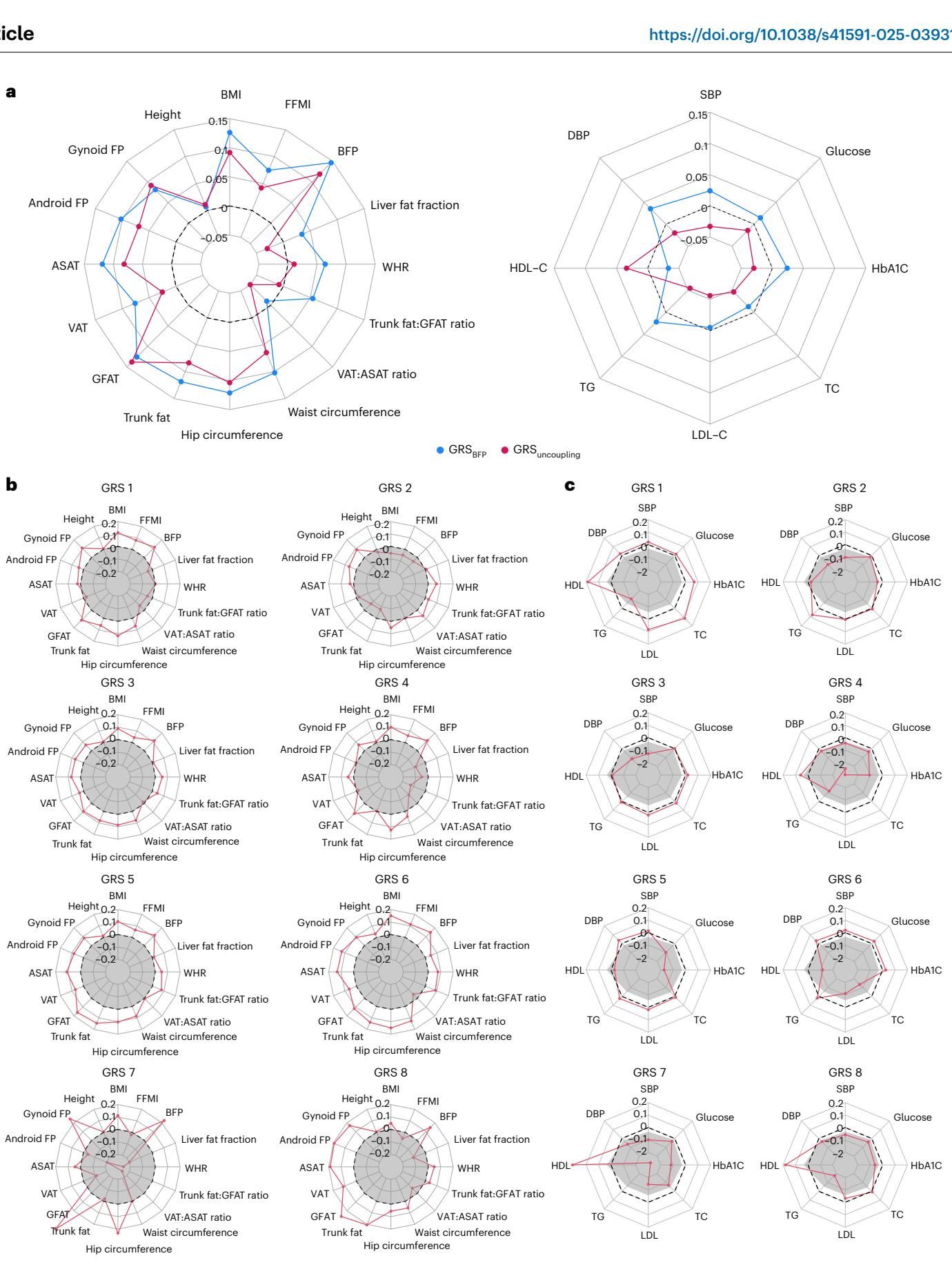
从图[2]的a部分(上图)可以清楚地看到,蓝线代表的(普通体脂评分)在右侧的代谢指标区域呈现出显著的扩张,意味着它与高血压(SBP/DBP)、高血糖(Glucose/HbA1c)和高甘油三酯(TG)正相关。然而,红线代表的(解耦评分)在这些区域却呈现收缩状态(位于中心圆圈内部),这直观地表明了其对代谢健康的保护作用——即便是脂肪增加了,代谢风险指标却是下降的。此外,红线在左侧的脂肪分布指标上也显示出独特的模式,尤其是在内脏脂肪(VAT)与皮下脂肪(ASAT)的比值上显著更低,暗示了这些“健康肥胖”基因倾向于让脂肪储存在皮下而非内脏,这正是代谢健康的关键所在。
3. 肥胖的八种“面孔”:不仅仅是胖瘦之别
这项研究最令人兴奋的发现之一,是揭示了“健康肥胖”并非铁板一块。研究团队利用聚类算法(NAvMix),根据这266个变异对各种身体特征的影响模式,将它们细分为了8种截然不同的遗传亚型(Clusters)。这意味着,通往“胖而健康”的道路至少有八条,每一条背后的生理机制都不尽相同。
这八种亚型各自有着独特的“性格”:
- 全能保护型(如第4、7、8号亚型): 这些亚型的基因携带者虽然体脂较高,但在多个代谢维度上都表现出显著的优势。例如,第4号亚型的特点是拥有更健康的血脂和血糖水平,这可能归功于他们更有利的脂肪分布——脂肪更多地长在皮下而不是内脏。
- 特定偏科型(如第3、5号亚型): 有些亚型则表现出特定的保护作用。第3号亚型主要与更低的血压相关,而第5号亚型则专注于改善血糖控制。
- 复杂的混合型(如第1、6号亚型): 它们的表现更为复杂,例如第1号亚型虽然伴随着较低的甘油三酯和较高的“好胆固醇”,但同时也可能伴随较高的“坏胆固醇”。
这种精细的差异在可视化图表中得到了生动的展示。如图[2]的b和c部分所示,8个不同的雷达图就像8个不同的指纹,清晰地描绘了每种遗传亚型对身体特征的独特影响。
从图[2]中我们可以观察到,代表第4号亚型(GRS 4)的雷达图在“代谢健康”区域(右侧)表现出明显的向内收缩(保护效应),同时在“脂肪分布”区域(左侧)显示出更有利的模式(如更低的腰臀比WHR)。相比之下,第2号亚型(GRS 2)则展示了一个独特的轮廓:它主要驱动了梨形身材(更高的臀围和腿部脂肪),同时伴随着较低的血压。这些发现告诉我们,肥胖并不是一个同质化的整体,而是一系列具有不同代谢后果的生理状态的集合。
4. 并非“免死金牌”:代谢健康不等于完全健康
既然存在“健康肥胖”基因,那么携带这些基因的人是否就彻底高枕无忧了呢?为了回答这个问题,研究人员进行了一项覆盖全表型组的关联分析(PheWAS),考察了这两种遗传评分与超过10,000种疾病结局的关系。
结论既令人欣慰,又发人深省:“解耦”基因确实能保护心脏和代谢,但无法抵消体重的物理负担。
如图[3]所示,这幅森林图直观地对比了普通肥胖评分(蓝色,)和解耦评分(红色,)在不同疾病上的风险差异。
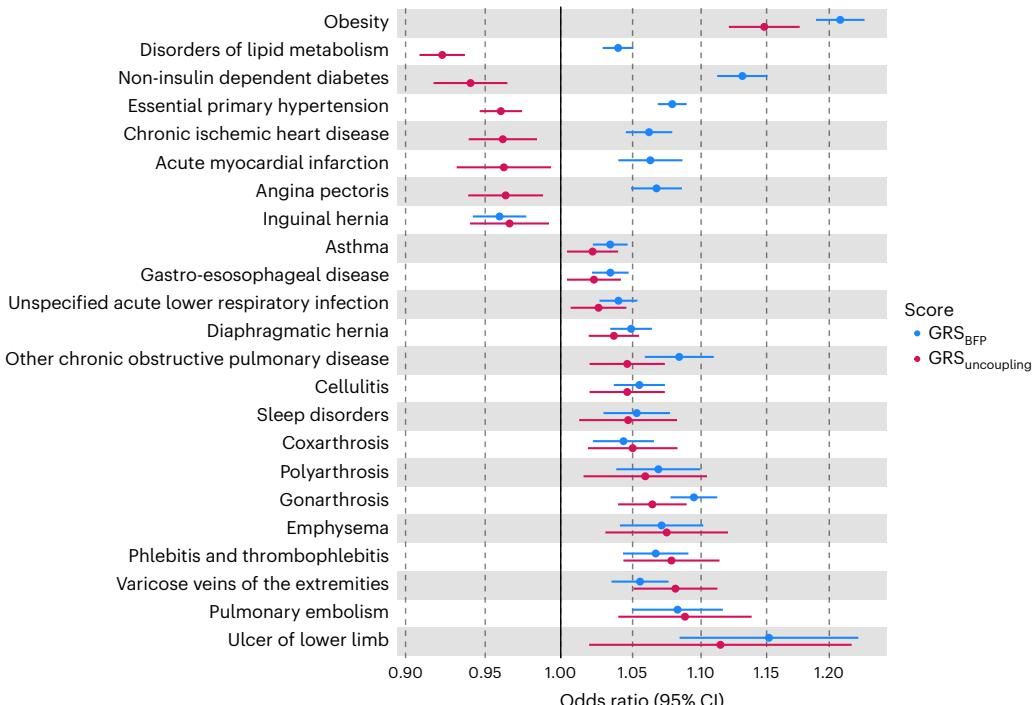
从图[3]中可以看到,在图表上半部分的代谢性疾病区域,红蓝两点分道扬镳:
-
心血管与代谢红利: 携带“解耦”基因(红点)的人,其患脂质代谢紊乱、2型糖尿病、高血压、缺血性心脏病以及心肌梗死的风险显著降低(位于中心线左侧)。这有力地证实了这些基因在维护代谢健康方面的核心价值。
-
物理重力的代价: 然而,当我们把目光移向图表下半部分,情况发生了反转。在膝关节病(Gonarthrosis)、静脉曲张(Varicose veins)、蜂窝织炎等与体重负荷密切相关的疾病上,红点和蓝点“殊途同归”,都位于中心线右侧,且风险增加的幅度惊人地一致。
这揭示了一个残酷的现实:即便基因能帮你“作弊”,让脂肪不破坏新陈代谢,但物理学定律依然公平——过大的体重依然会压垮你的关节,阻碍你的静脉回流。因此,“健康肥胖”是一个相对的概念,它仅限于代谢层面,而非全身健康的“免死金牌”。
5. 深入机理:大脑 vs. 脂肪组织
如果说普通肥胖和“解耦”肥胖在临床表现上大相径庭,那么它们背后的生物学机制又有何不同?为了解开这个谜题,研究团队对这两组基因进行了组织富集分析。
分析结果揭示了两者在“主战场”上的根本差异:
- 普通肥胖(): 相关的基因高度富集在中枢神经系统(CNS)。这与既往认知一致,即普通肥胖很大程度上源于大脑对食欲、饱腹感和能量平衡的调控失衡。
- “解耦”肥胖(): 相关的基因则完全避开了大脑,转而富集在外周组织,特别是脂肪组织、心血管系统、肌肉骨骼系统和消化系统。
这种机制上的分野在图[4]中得到了清晰的展示。
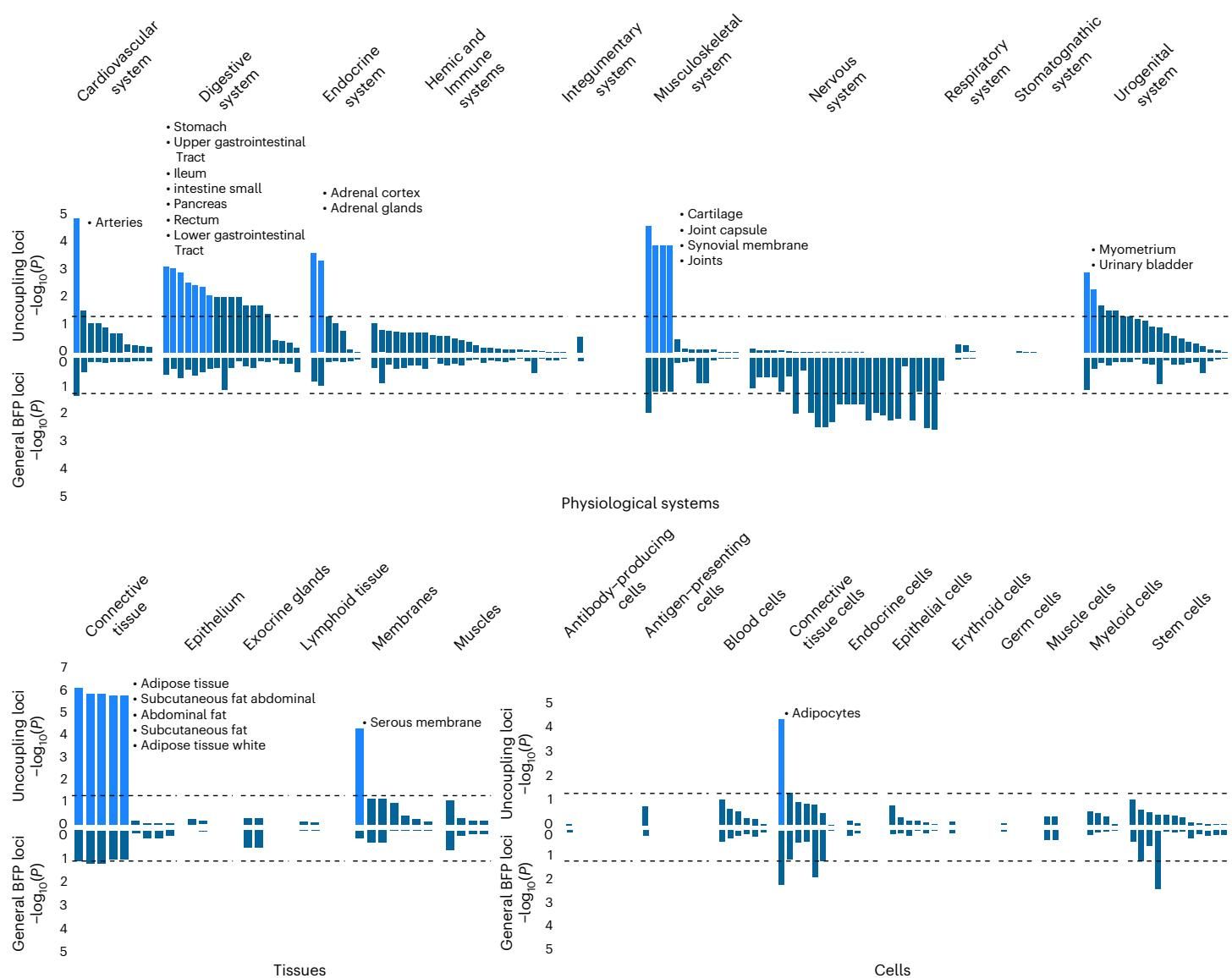
从图[4]中我们可以看到,下方的深蓝色条形图(代表普通肥胖基因)在“神经系统”(Nervous system)这一栏有着极高的峰值,表明其主要作用于大脑。相反,上方的浅蓝色条形图(代表解耦基因)在神经系统几乎没有信号,但在“脂肪组织”(Adipose tissue)、“肌肉骨骼系统”(Musculoskeletal system)和“心血管系统”等外周组织中表现出显著的富集。这意味着,“健康肥胖”更多是由脂肪细胞本身的特性(如储存能力、炎症反应)以及外周器官的代谢处理能力决定的,而不是由大脑控制的摄食行为决定的。
进一步的基因功能分析发现,这些“解耦”基因参与了诸多关键生理过程,包括脂肪组织的扩张能力(能否把脂肪安全地存起来而不溢出)、胰岛素信号传导、血管发育甚至是骨骼肌的发育。这暗示了改善代谢健康的关键可能在于提高外周组织处理营养过剩的能力。
6. 血液中的线索:蛋白质组学的证据
为了寻找这种遗传效应在血液中的“指纹”,研究人员还分析了近3000种血浆蛋白质。结果发现,虽然许多与脂肪量相关的蛋白(如瘦素)在两组人群中都升高了,但也有一部分蛋白表现出了截然相反的趋势,这些蛋白很可能就是连接基因与代谢健康的桥梁。
如图[5]所示,这张散点图展示了血浆蛋白与两种遗传评分的关联方向。
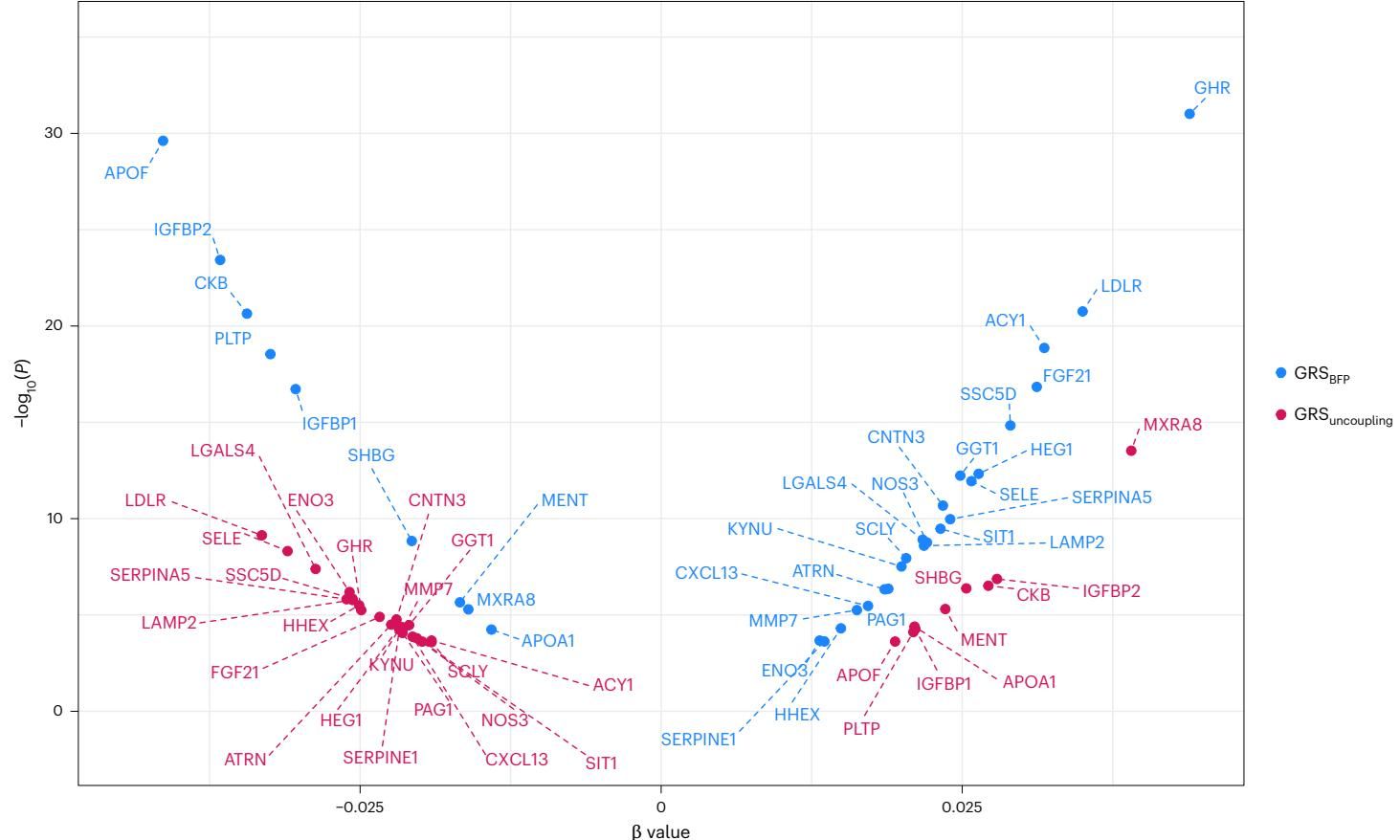
在图[5]中,我们可以观察到一些有趣的现象:
- 一致性(右上角和左下角): 绝大多数蛋白(如瘦素LEP、FABP4)沿着对角线分布,意味着无论你是哪种肥胖,脂肪多了,这些蛋白就会随之升高。它们反映的是体内总脂肪量的多少。
- 背道而驰(左上角和右下角): 然而,有些蛋白偏离了对角线。例如,IGFBP1和IGFBP2(胰岛素样生长因子结合蛋白)以及SHBG(性激素结合球蛋白)在“解耦”评分高的人群中是升高的(红点),而在普通肥胖评分高的人群中却是降低的(蓝点)。这些蛋白已知与更高的胰岛素敏感性和更好的代谢健康相关。反之,像LDLR(低密度脂蛋白受体)在“解耦”人群中水平较低,这可能反映了肝脏对脂质清除能力的增强。
这些特异性改变的蛋白,不仅验证了遗传分析的结果,也为未来开发模拟“健康肥胖”效应的药物提供了潜在的靶点。
论文信息
- 标题:Genetic subtyping of obesity reveals biological insights into the uncoupling of adiposity from its cardiometabolic comorbidities.
- 论文链接:https://doi.org/10.1038/s41591-025-03931-0
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-11
- 期刊/会议:Nature medicine
- 作者:Nathalie Chami, Zhe Wang, Victor Svenstrup, ..., Ruth J F Loos
本文由超能文献AI辅助创作,内容仅供学术交流参考,不代表任何医学建议。
References
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/c2qdoia9hj52yw4sclrm2hbf_1_9494881cef.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/c2qdoia9hj52yw4sclrm2hbf_2_06e8b5a4e6.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/c2qdoia9hj52yw4sclrm2hbf_3_cf707b9ca7.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/c2qdoia9hj52yw4sclrm2hbf_4_ff4a789c1e.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/c2qdoia9hj52yw4sclrm2hbf_5_7088569ef9.jpg
分享
推荐阅读

人类能活到150岁吗?Nature揭示抗衰老研究最新突破
Nature最新专题报道揭示两位顶级科学家关于人类能否活到150岁的争论,IL-11抑制剂在小鼠实验中延长寿命25%,谷歌子公司Calico投资近6亿美元开发抗衰老药物,多种疗法正在临床试验。

FDA移除更年期激素疗法"黑框警告":20年争议终结,还是新风险开始?
FDA于2025年11月10日移除更年期激素替代疗法黑框警告,结束20年争议。深度解读WHI研究误读、政策反转逻辑与全球1.2亿女性的健康选择。

合成舌头检测辣椒辣度:牛奶蛋白启发的传感器革新食品安全检测
华东理工大学团队研发出受牛奶启发的酪蛋白凝胶传感器,可精确测量辣椒辣度,避免人工品尝风险。这项发表于ACS Sensors的技术有望革新食品质量控制标准。
