
殊途同归的“隐形战场”:揭秘晚期前列腺癌的种族基因组差异
在精准医疗的宏大叙事中,我们常常假设癌症的生物学特征在人群中是相对均质的,或者至少其变异是有迹可循的。长期以来,前列腺癌的研究构建了我们对这一男性常见恶性肿瘤的认知基石。众所周知,非裔美国男性不仅前列腺癌的发病率更高,而且其癌症特异性死亡率也高于欧裔美国男性;相比之下,亚裔男性通常表现出较低的患病风险[[null]]。这些基于种族的人群差异已成为流行病学常识。
然而,当我们把目光聚焦到前列腺癌最凶险、最致死的形式——转移性去势抵抗性前列腺癌(mCRPC)时,这一认知的清晰度却变得模糊起来。
过去的基因组研究多集中于局限性(早期)前列腺癌,我们对那些已经发生转移、且对激素疗法产生抵抗的晚期肿瘤在不同种族间的差异知之甚少。当癌症进化到这一终极阶段,它是殊途同归变得千篇一律,还是依然保留着与其宿主族裔背景紧密相关的独特生物学印记?更重要的是,现有的基因组图谱是否因为缺乏多样性样本,而让我们错失了为特定人群寻找救命药物的机会?
为了解开这一谜题,来自加州大学旧金山分校(UCSF)等机构的研究团队,整合了四个大型 mCRPC 肿瘤活检队列,对 445 名男性的肿瘤进行了深度的转录组学和基因组学分析。这项发表于 Prostate Cancer and Prostatic Diseases 的最新研究,为我们揭示了晚期前列腺癌在不同种族患者体内截然不同的分子图景。
1. 相同的终点,不同的通路:转录组层面的分歧
这项研究最引人注目的发现之一,在于即便患者处于临床表现相似的晚期阶段,其肿瘤细胞内部活跃的信号通路却大相径庭。研究人员重点对比了非裔美国患者与欧裔美国患者的肿瘤基因表达谱,利用基因集富集分析(GSEA)技术,捕捉到了肿瘤生物学行为的显著差异。
1.1 MYC 通路的激活与免疫信号的沉寂
分析显示,在非裔美国患者的肿瘤中,著名的致癌基因 MYC 及其相关通路的表达水平显著高于欧裔美国患者。MYC 就像是细胞分裂的“油门”,它的过度活跃往往预示着肿瘤具有更强的增殖能力。然而,更有趣的现象发生在免疫相关的信号通路上。
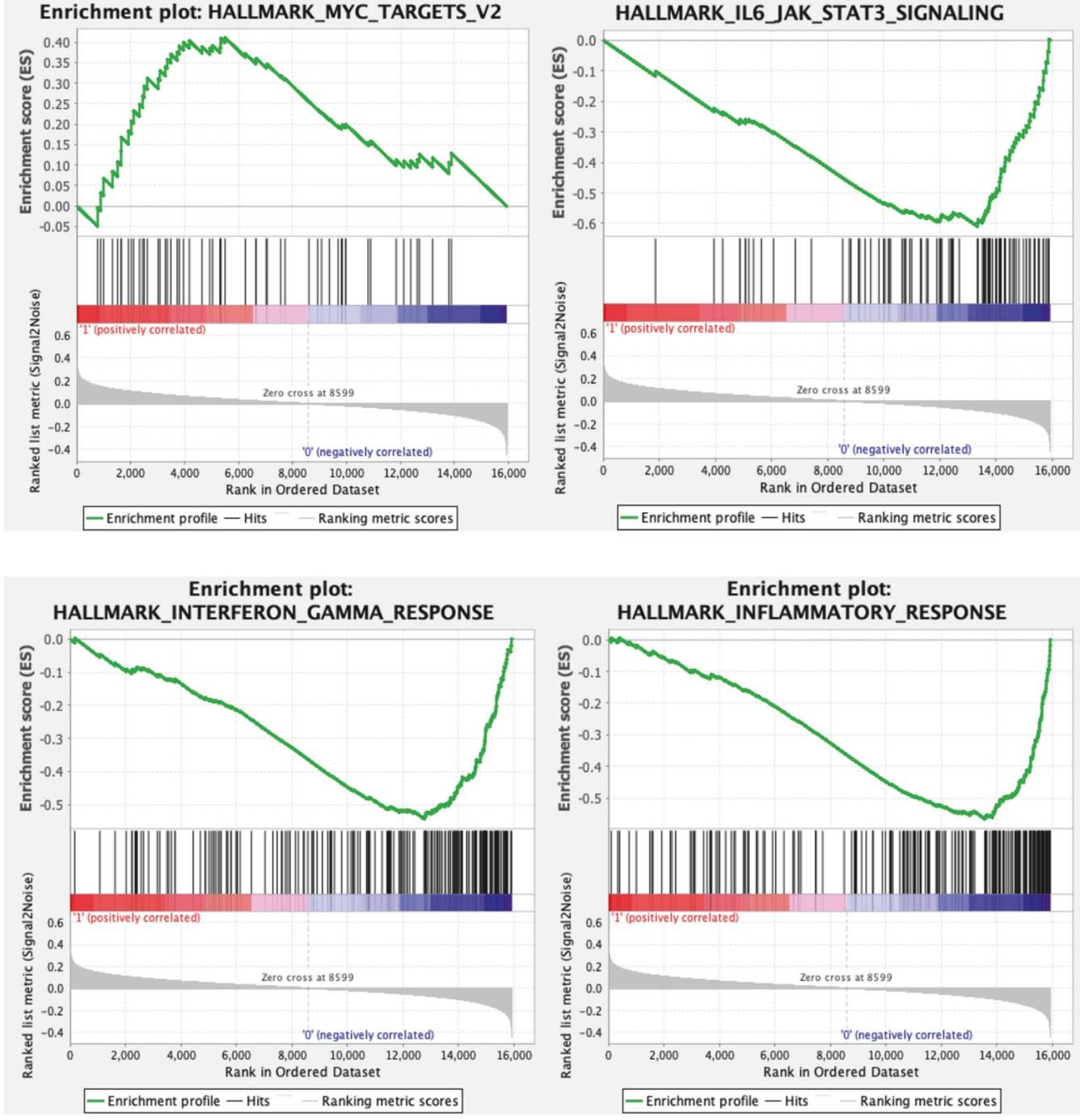
如图[1]所示,研究人员通过精细的 GSEA 分析图展示了这种鲜明的对比。让我们将目光投向这组图表:左上角的图表展示了 MYC 靶基因集合的富集评分(Enrichment Score),那条绿色的曲线在图表左侧陡然上升,形成一个显著的峰值,这直观地告诉我们,相比于欧裔患者,非裔美国患者(红色标记部分)的肿瘤样本中 MYC 信号通路被强烈激活。然而,故事的另一面则更为深沉。观察图[1]中其余的三张图表——分别代表 IL-6/JAK/STAT3 信号通路(右上)、干扰素-γ(IFN-γ)反应(左下)以及炎症反应通路(右下),我们会发现截然相反的趋势。这些曲线呈现出明显的下行低谷,意味着这些对免疫调节至关重要的通路基因在非裔美国患者的肿瘤中表达显著下调。这种“一高三低”的模式(MYC 高,免疫/炎症通路低)清晰地勾勒出了非裔美国男性 mCRPC 独特的肿瘤微环境特征——一种可能更具侵袭性但免疫反应相对“冷寂”的状态[[null]]。
2. 基因组的底层代码:DNA 变异的种族特异性
除了转录组层面的差异,研究团队还深入挖掘了 DNA 层面的变异,试图找到驱动这些癌症发展的“底层代码”。在这里,他们确认了一个在早期前列腺癌中已知的现象在晚期癌症中依然存在:TMPRSS2:ERG 基因融合。
2.1 融合基因与驱动突变的分布不均
TMPRSS2:ERG 基因融合是前列腺癌中最常见的基因组改变之一,它通常被视为肿瘤发生的早期驱动事件。但在不同种族间,这一事件的发生频率并不均衡。
从图[2]中我们可以清晰地看到不同驱动基因在各人种中的变异频率差异。请注意右上角的 TMPRSS2:ERG-fusion 柱状图,代表白人(White,蓝色柱)的条柱高达 41%,显得尤为突出;而紧邻的代表非裔美国人(Black or African American,绿色柱)的条柱则骤降至 11%(P = 0.015)。这种视觉上的巨大落差有力地证实了,这种在欧裔患者中占主导地位的致癌机制,在非裔患者中并非主要推手。
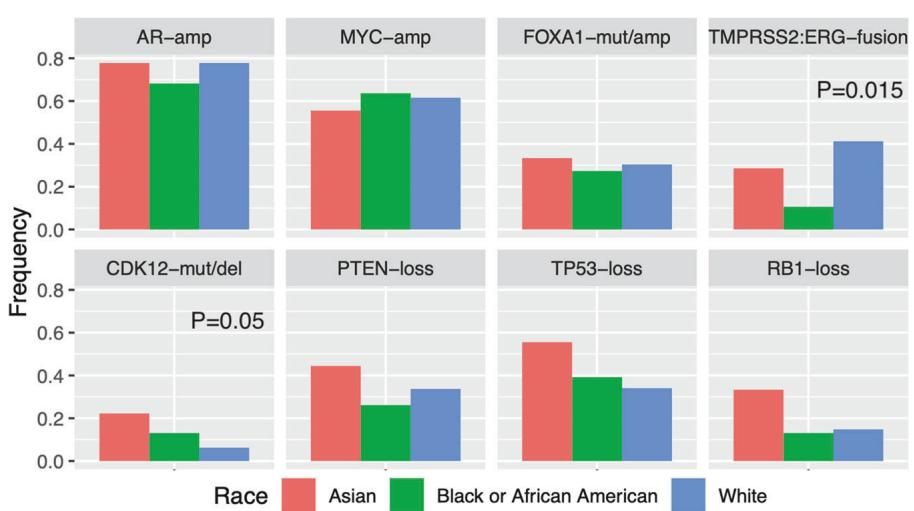
此外,图[2]还展示了其他关键基因的微妙差异。例如,在第二行最左侧的 CDK12 突变/缺失图中,代表亚裔(Asian,红色柱)的数值高达 22%,显著高于非裔(13%)和白人(6%)。尽管本研究中亚裔样本量较小(N=9),但这与之前的研究报道相吻合,提示 CDK12 变异可能是亚裔前列腺癌患者的一个重要特征。与此同时,我们还可以观察到 FOXA1 变异以及 PTEN、RB1 和 TP53 等抑癌基因的双等位基因缺失在亚裔患者中显示出较高的倾向,虽然统计学上尚未达到显著性差异,但这无疑为未来的针对性研究指明了方向。
3. 临床悖论与未来的治疗曙光
尽管我们在分子生物学层面观察到了如此巨大的鸿沟——从基因表达的信号通路到 DNA 结构的变异频率,非裔美国患者与欧裔美国患者似乎患的是两种“不同”的疾病,但在临床预后上,这一差异却消失了。
研究结果显示,在接受了标准治疗后,不同种族患者的总生存期(Overall Survival)并没有显著差异,中位生存期均在 20.9 个月左右。这似乎是一个“悖论”:既然生物学特征如此不同,为何最终的临床结局却殊途同归?
这恰恰是精准医疗需要介入的关键点。生存期相似并不意味着治疗路径应当相同。研究中发现的非裔美国患者体内 IFN-γ 和 JAK/STAT 通路的低表达具有极高的临床转化价值。近期有研究表明,干扰素-γ(IFN-γ)治疗可以增加 mCRPC 模型对紫杉烷类化疗的敏感性;而 JAK 抑制剂也正在作为一种对抗雄激素受体通路抑制剂(ARPI)耐药性的新策略被开发。
这意味着,如果我们盲目地将基于欧裔人群数据开发的药物应用于所有患者,可能会导致部分患者获益有限,甚至产生耐药。例如,针对 JAK/STAT 通路的靶向疗法,在通路活性本来就低的非裔患者体内,其疗效和安全性是否需要重新评估?反之,这是否提示我们需要开发针对 MYC 高表达的特异性疗法来造福这一人群?
这项研究虽然受限于非欧裔样本的数量(这也是当前医学研究面临的普遍挑战),但它像一盏探照灯,照亮了晚期前列腺癌基因组图谱中的“暗区”。它提醒我们,种族多样性不仅是社会正义的要求,更是科学严谨性的基石。只有在未来的临床试验和基因组分析中纳入更多元化的人群,我们才能真正读懂癌症这部复杂的“天书”,为每一位患者找到属于他们的生存密码。
论文信息
- 标题:Racial variation in the advanced prostate cancer genome.
- 论文链接:https://doi.org/10.1038/s41391-025-00949-w
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-12
- 期刊/会议:Prostate cancer and prostatic diseases
- 作者:Emily M Feng, Jenny Vo-Phamhi, Aishwarya N Subramanian, ..., William S Chen
本文由超能文献AI辅助创作,内容仅供学术交流参考,不代表任何医学建议。
References
分享
推荐阅读

减重20%的口服药来了:减肥针的终结者还是新战场?
礼来新型口服减肥药eloralintide临床试验显示20%减重效果,与GLP-1注射剂效果相当但更便捷。千亿美元减肥药市场,口服制剂能否改写游戏规则?

孕期止痛药风波:扑热息痛真的会导致娃“多动”或“自闭”吗?
本文深入探讨了孕期使用扑热息痛与后代自闭症/多动症关联的争议。通过一项对现有系统综述的“伞形评价”和同胞对照研究,揭示了此前观察到的关联可能源于家庭遗传和环境因素,而非药物本身。研究强调了高热的风险,并重申扑热息痛仍是孕期安全的退烧止痛首选。

MIT开源BoltzGen:AI设计蛋白质药物,向"不可成药"靶点宣战
MIT团队推出开源AI模型BoltzGen,在26个挑战性靶点上实现纳摩尔级结合亲和力,67%成功率打破蛋白质设计困境,免费商用或颠覆制药行业格局。

10亿肥胖患者的"救命药",WHO开了绿灯却标上天价
2025年12月1日,世卫组织发布首个GLP-1药物治疗肥胖指南,覆盖司美格鲁肽等三大药物。但年费用上万美元,2030年仅10%患者可及,药企与医保的博弈才刚开始。

GLP-1s不止减重:从胰岛素到神经保护的“超级激素”

你的身体在44岁和60岁经历了什么?Stanford研究揭示衰老的两次"地震"
Stanford Medicine追踪108人数年,分析13.5万种分子,发现衰老并非匀速过程,而是在44岁和60岁出现两次剧烈波动,心血管、代谢、免疫系统均受影响。