
多年来,医学界一直认为化疗引起的神经损伤是药物直接攻击神经细胞的结果。但最新发表在《科学·转化医学》(Science Translational Medicine)杂志上的一项研究彻底改写了这一认知——真正的"肇事者"竟然是免疫细胞。这个出人意料的发现,不仅解释了为什么近半数接受化疗的患者会遭受难以忍受的手脚麻木和疼痛,更重要的是,它指向了一个已经在临床试验中的治疗靶点。
这项由威尔康奈尔医学院(Weill Cornell Medicine)和维克森林大学医学院(Wake Forest University School of Medicine)合作完成的研究,揭示了化疗药物紫杉醇如何"误伤"患者神经系统的完整链条:药物激活免疫细胞内部的分子"警报器"IRE1α,引发过度炎症反应,最终导致神经纤维受损[1]。研究于2025年10月29日发表。
一场错误的"警报"引发的灾难
威尔康奈尔医学院感染与免疫学教授Juan Cubillos-Ruiz博士和他的团队发现,紫杉醇这种广泛使用的化疗药物会促使免疫细胞产生大量活性氧(reactive oxygen species)——这些分子会给细胞带来巨大压力。压力积累到一定程度,免疫细胞内的IRE1α-XBP1通路就会被激活,就像一个敏感的烟雾报警器突然响起。
问题在于,这个"警报"并不准确。IRE1α通路本是细胞应对压力的自我保护机制,但在化疗药物的刺激下,它却把免疫细胞推向了一种极度炎症的状态。这些被过度激活的免疫细胞随后向背根神经节(dorsal root ganglia)——连接四肢和脊髓的感觉神经中枢——进军,在那里释放炎症因子,刺激并损伤神经纤维。
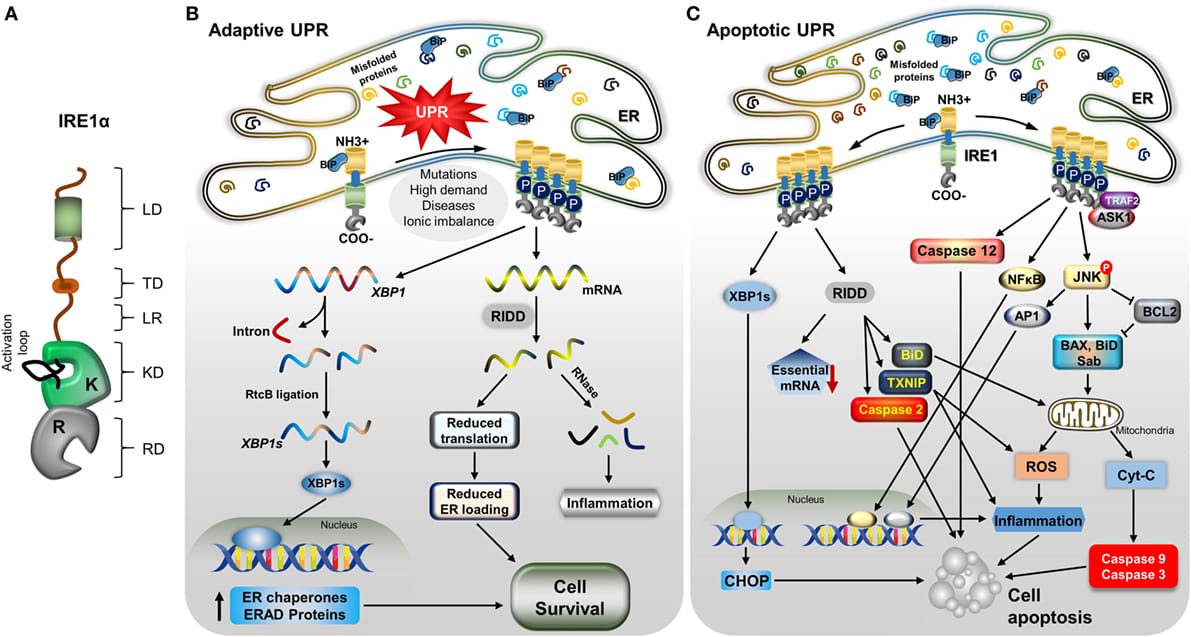 IRE1α应激反应通路在免疫细胞中的作用机制(图片来源:Frontiers in Immunology)
IRE1α应激反应通路在免疫细胞中的作用机制(图片来源:Frontiers in Immunology)
"我们发现的分子机制特异性地定位于免疫细胞,而非神经元,"Cubillos-Ruiz博士强调,"这提供了强有力的证据,表明化疗诱导的神经病变不仅仅是神经问题,而是一个由细胞应激反应驱动的免疫介导炎症过程。"[1]
基因工具和药物双重验证
研究团队使用了一个广泛认可的小鼠模型,该模型能够准确反映癌症患者经历的神经损伤。当研究人员通过基因技术在免疫细胞中沉默IRE1α后,小鼠的炎症反应被有效阻断,化疗诱导的周围神经病变(CIPN)相关行为也显著减少。
更令人兴奋的是药物实验的结果。研究团队测试了一种专门阻断IRE1α的小分子抑制剂——这种药物目前已经在针对晚期实体瘤的1期临床试验中接受评估。当小鼠同时接受化疗和IRE1α抑制剂治疗时,它们表现出的疼痛行为明显减少,神经组织也保持得更加健康[1]。
"我们的研究结果表明,通过药物靶向IRE1α可以减轻紫杉类药物诱导的神经病变,帮助患者继续接受化疗而无需承受神经损伤的负面影响,"Cubillos-Ruiz博士说。由于IRE1α抑制剂目前正在癌症患者中进行测试——该通路的过度激活本身就会促进癌症生长和治疗耐药——这项新发现意味着同一种药物可能具有双重益处:既能提高癌症治疗效果,又能保护患者免受化疗引起的神经损伤[1]。
血液测试预测谁会受伤
为了探索这些临床前研究发现如何应用于实际患者,研究团队开展了一项小型试点研究,招募了接受紫杉醇治疗的妇科癌症女性患者。他们在每个化疗周期前后采集血液样本,检测循环免疫细胞中IRE1α-XBP1通路的激活程度。
结果令人印象深刻:那些后来发展为严重CIPN的患者,即使在症状出现之前,其血液免疫细胞中的IRE1α-XBP1通路激活水平就已经明显升高[1]。
这个早期信号意味着,未来可能通过一个简单的血液测试,在神经损伤发生之前就识别出高风险患者,并采取预防措施——或许包括使用IRE1α抑制剂——来阻止损伤的发生。维克森林大学医学院麻醉学教授E. Alfonso Romero-Sandoval博士表示:"我们的研究为进一步探索这一通路是否可以用于预测哪些患者会出现这种症状打开了机会,从而帮助临床医生实施个体化治疗。"[2]
为何这项发现如此重要
化疗诱导的周围神经病变(CIPN)是癌症治疗中最常见且最具限制性的副作用之一。数据显示,接受化疗的患者中有高达50%会经历这一问题[1]。患者会感到手脚刺痛、麻木和疼痛,症状严重时甚至无法系扣子、握笔或行走。更糟糕的是,由于缺乏有效的治疗手段,许多患者被迫提前终止可能挽救生命的化疗。
过去,医学界普遍认为CIPN是化疗药物直接毒害神经细胞的结果,因此研究主要集中在神经保护策略上。但这些努力收效甚微。现在,这项研究彻底转变了思路:既然问题的根源在免疫细胞,那么调控免疫反应就成为了更有前景的干预路径。
IRE1α通路本身是内质网应激(endoplasmic reticulum stress)反应的核心组分,在细胞面临蛋白折叠压力时被激活。Cubillos-Ruiz博士团队此前的研究已经证实,这一通路在术后疼痛和炎症模型中也发挥促进作用[1]。如今在CIPN领域的新发现,进一步巩固了IRE1α作为疼痛和炎症治疗靶点的地位。
双重获益的治疗前景
这项研究最吸引人的地方在于其临床转化的可行性。IRE1α抑制剂已经在癌症临床试验中接受安全性和有效性评估,因为肿瘤细胞常常依赖IRE1α通路来适应恶劣的微环境并抵抗治疗[1]。如果这些抑制剂被证明安全有效,那么它们可以同时发挥两个作用:
一方面,直接攻击癌细胞赖以生存的应激适应机制,增强化疗效果。另一方面,阻断免疫细胞中的IRE1α激活,预防或减轻化疗引起的神经损伤,让患者能够完成完整疗程而不必因副作用而中断治疗。
Cubillos-Ruiz博士指出,这种双重益处"可能显著改善癌症治疗的效果和患者的生活质量"[1]。对于那些本已承受巨大身心压力的癌症患者来说,避免额外的神经病变折磨,意味着更高的治疗依从性和更好的长期预后。
未来研究的方向
尽管这项研究令人振奋,但仍有许多问题有待解答。研究团队计划开展更大规模的临床研究,以验证IRE1α-XBP1通路激活水平是否可以作为可靠的生物标志物,预测CIPN的发生和严重程度[2]。同时,他们也希望测试IRE1α抑制剂是否能够安全有效地预防或减轻癌症患者的神经损伤。
此外,研究人员还想探索这一机制是否适用于其他类型的神经性疼痛。如果IRE1α在免疫细胞中的作用是一个更普遍的疼痛触发机制,那么相关抑制剂或许能够帮助更广泛的慢性疼痛患者。
值得注意的是,这项研究还提出了一个更深层次的科学问题:为什么演化保留了这样一个容易"误伤"自身的应激反应机制?或许在正常生理条件下,IRE1α通路的激活是一种必要的权衡——它帮助免疫细胞应对感染和损伤,但在化疗这种极端压力下,系统的平衡被打破了。理解这种平衡的本质,可能会为更精准的干预策略提供线索。
从实验室到病床
这项研究得到了美国国立卫生研究院(NIH)下属的国家癌症研究所(National Cancer Institute)和国家神经疾病与中风研究所(National Institute of Neurological Disorders and Stroke)的资助,以及美国国防部(U.S. Department of Defense)的支持[1][2]。多机构联合资助反映了CIPN问题的紧迫性和重要性。
对于正在接受或即将接受化疗的患者来说,这项研究带来了真实的希望。虽然IRE1α抑制剂还需要更多临床数据来证明其在预防CIPN方面的效果,但研究方向的转变本身就是一个重大突破。从"保护神经细胞"到"调控免疫反应",这不仅是治疗策略的改变,更是对疾病机制认识的根本性更新。
随着对IRE1α通路在不同细胞类型和疾病状态下作用的深入理解,我们或许正站在疼痛和炎症治疗新时代的门槛上。对于那些饱受化疗副作用折磨的患者,这个"幕后黑手"的身份曝光,意味着更精准的打击和更光明的治疗前景。
参考文献
[1] Weill Cornell Medicine. (2025, November 20). Scientists Identify a Molecular Switch to a Painful Side Effect of Chemotherapy. Weill Cornell Medicine Newsroom. https://news.weill.cornell.edu/news/2025/11/scientists-identify-a-molecular-switch-to-a-painful-side-effect-of-chemotherapy
[2] Wake Forest University School of Medicine. (2025, October 29). Researchers uncover key mechanism behind chemotherapy-induced nerve damage. Wake Forest Baptist Health Newsroom. https://newsroom.wakehealth.edu/news-releases/2025/10/researchers-uncover-key-mechanism-behind-chemotherapy-induced-nerve-damage
[3] Romero-Sandoval, E. A., et al. (2025). Leukocyte-intrinsic ER stress responses contribute to chemotherapy-induced peripheral neuropathy. Science Translational Medicine, 17(822). DOI: 10.1126/scitranslmed.ady5288
图片来源:
- IRE1α应激反应通路示意图: Frontiers in Immunology, https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2018.01289/full
本文由超能文献(https://suppr.wilddata.cn/)团队发表
分享



