
告别盲目筛查:AI心电图精准预测瓣膜病风险,中美百万数据验证
心脏瓣膜病(Valvular Heart Disease, VHD)常被视为一种“老年病”,影响着全球约4100万人 [1]。然而,它的可怕之处在于隐匿性:许多患者在早期没有任何症状,而当出现明显的呼吸困难或心力衰竭时,往往已错过了最佳干预窗口。及时发现并进行药物或手术干预能显著降低死亡率,但这带来了一个巨大的公共卫生挑战:我们不可能让所有人定期去做昂贵且耗时的超声心动图(Echocardiography)检查。
相比之下,心电图(ECG)是临床上最普及、最廉价的检查手段。长久以来,医学界的共识是心电图主要用于诊断心律失常或缺血,对结构性心脏病的诊断能力有限。但是,这一共识正在被人工智能打破。如果一张普通的12导联心电图不仅能诊断当下的疾病,还能预测未来5年你患上严重瓣膜病的风险,这将如何改变我们的诊疗模式?
近日,复旦大学附属中山医院与伦敦帝国理工学院的研究团队在心血管领域顶级期刊《欧洲心脏杂志》(European Heart Journal)上发表了一项重磅研究。该研究利用中、美两国超过100万份数据,开发并验证了一种能够预测未来心脏瓣膜反流风险的AI模型 [2]。这项成果不仅展示了AI在医学影像分析中的深度,更为解决医疗资源分配不均提供了一个极具前景的方案。
1. 这里的AI不仅能“看病”,还能“算命”
传统的心血管疾病风险预测往往依赖于人口学特征(如年龄、性别)或特定的超声参数,但至今缺乏系统的预测模型。现行指南建议对轻度瓣膜病患者进行定期超声监测,这种“广撒网”的策略对医疗资源造成了极大压力。
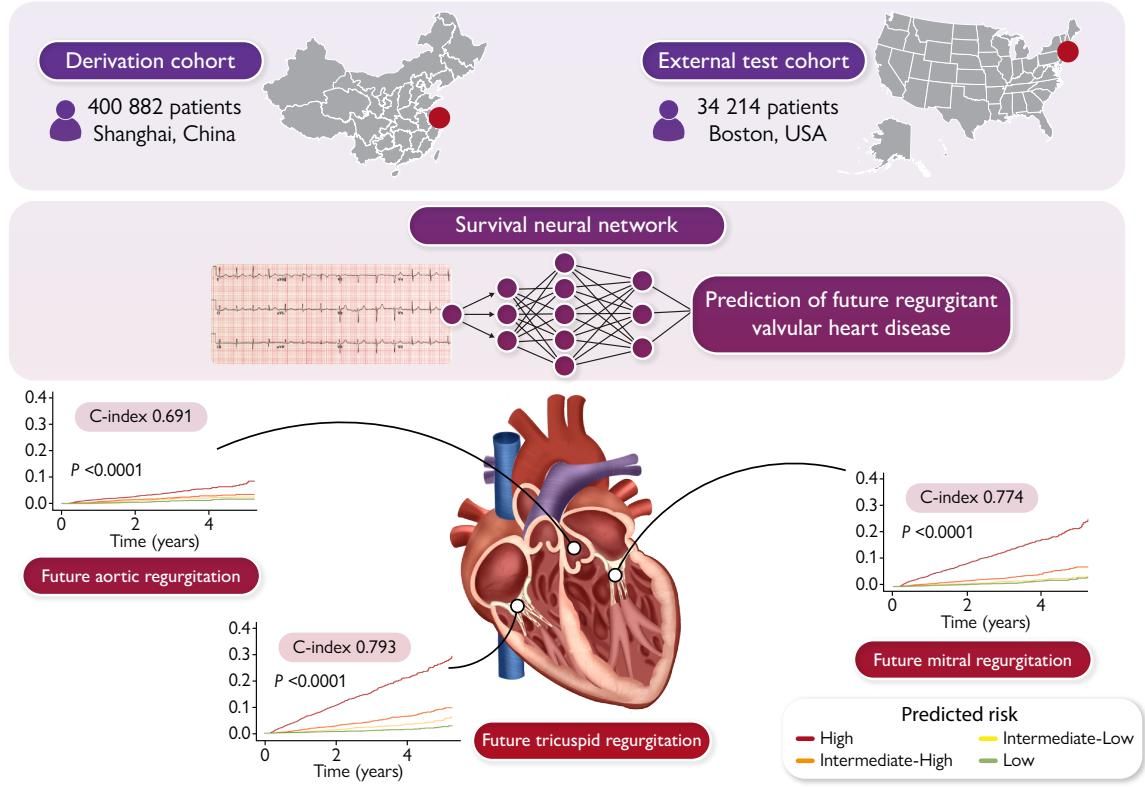
这项国际联合研究的核心创新点在于,它并未止步于让AI“诊断”当前的疾病,而是训练AI去“预测”未来的风险。研究团队构建了一个基于生存分析的深度学习模型(Survival Neural Network),专门用于评估三种最常见的反流性瓣膜病(rVHDs)的进展风险:二尖瓣反流(MR)、主动脉瓣反流(AR)和三尖瓣反流(TR)。
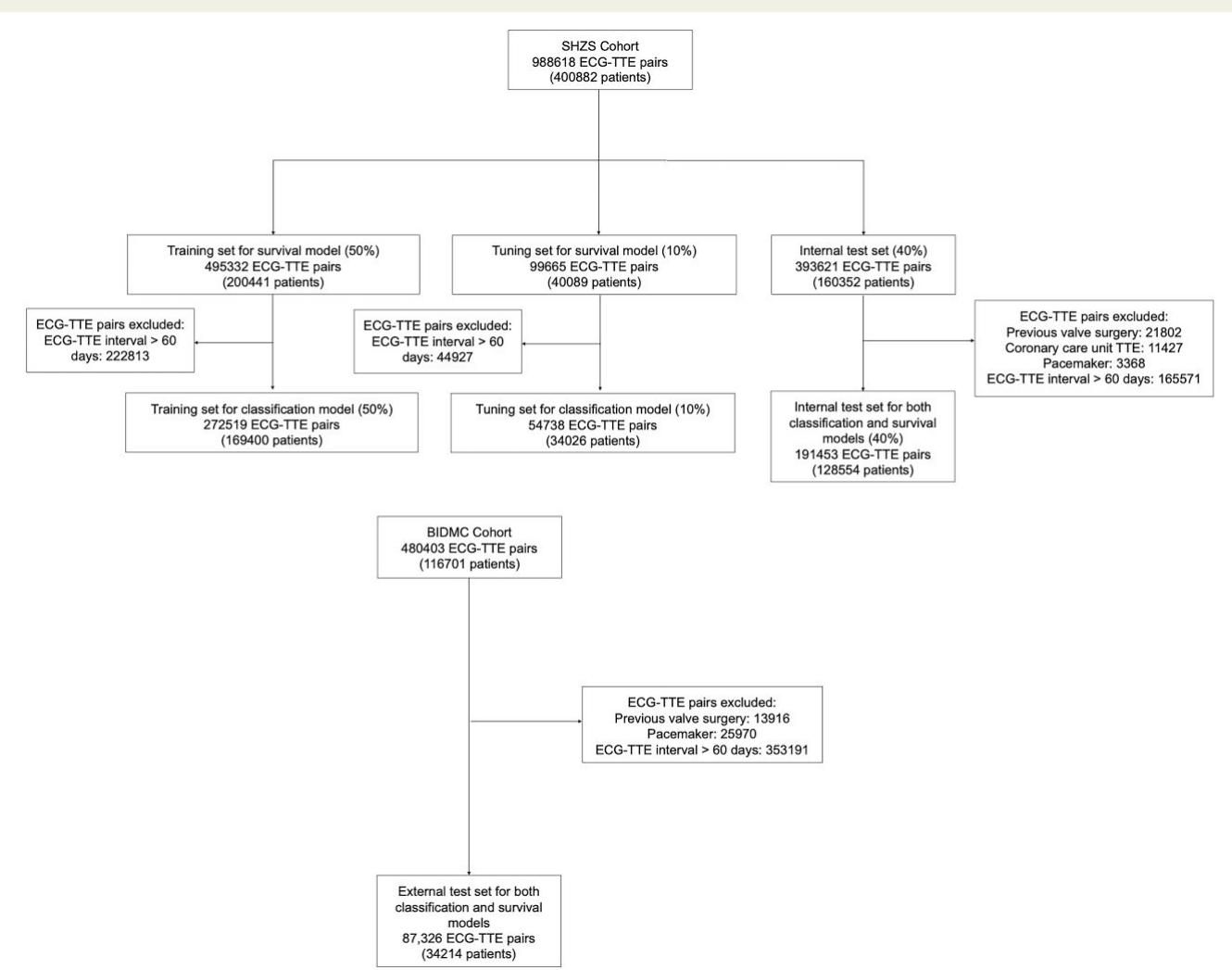
如图[2]所示,研究涵盖了极其庞大的数据集。开发队列来自中国上海中山医院(SHZS),包含了超过40万名患者的近100万对心电图和超声心动图数据;外部测试队列则来自美国波士顿贝斯以色列女执事医疗中心(BIDMC),涉及3.4万名患者。这种跨国界、跨人种的大规模验证,赋予了该模型极高的可信度。
从图[2]的流程设计中我们可以解读出,研究人员将心电图波形作为输入,通过复杂的神经网络处理,不仅输出了当前是否患病的判断,更给出了未来的风险评分。这就像是给心电图机装上了一双能“透视”未来的眼睛,它能从看似正常的电信号波动中,捕捉到心脏结构发生病变前的蛛丝马迹。
2. 数据说话:提前5年预警的底气
AI模型的预测能力究竟如何?数据给出了令人印象深刻的答案。
在中山医院的内部测试集中,该模型对未来发生中重度瓣膜反流的预测表现优异。具体而言,针对二尖瓣反流(MR)的预测C指数(C-index,一种衡量预测准确性的指标)达到了0.774,三尖瓣反流(TR)更是高达0.793。这意味着,AI能够非常准确地将未来可能患病的“高危人群”从普通人群中区分出来。
更直观的证据来自风险分层的对比。研究人员根据AI评分将患者分为低风险、中低风险、中高风险和高风险四组。
如图[3]所示,我们可以清晰地看到不同风险组患者在未来数年内的疾病进展轨迹。这几张Kaplan-Meier曲线图展示了随着时间推移(X轴),各组人群发生严重瓣膜病的累积事件率(Y轴)。
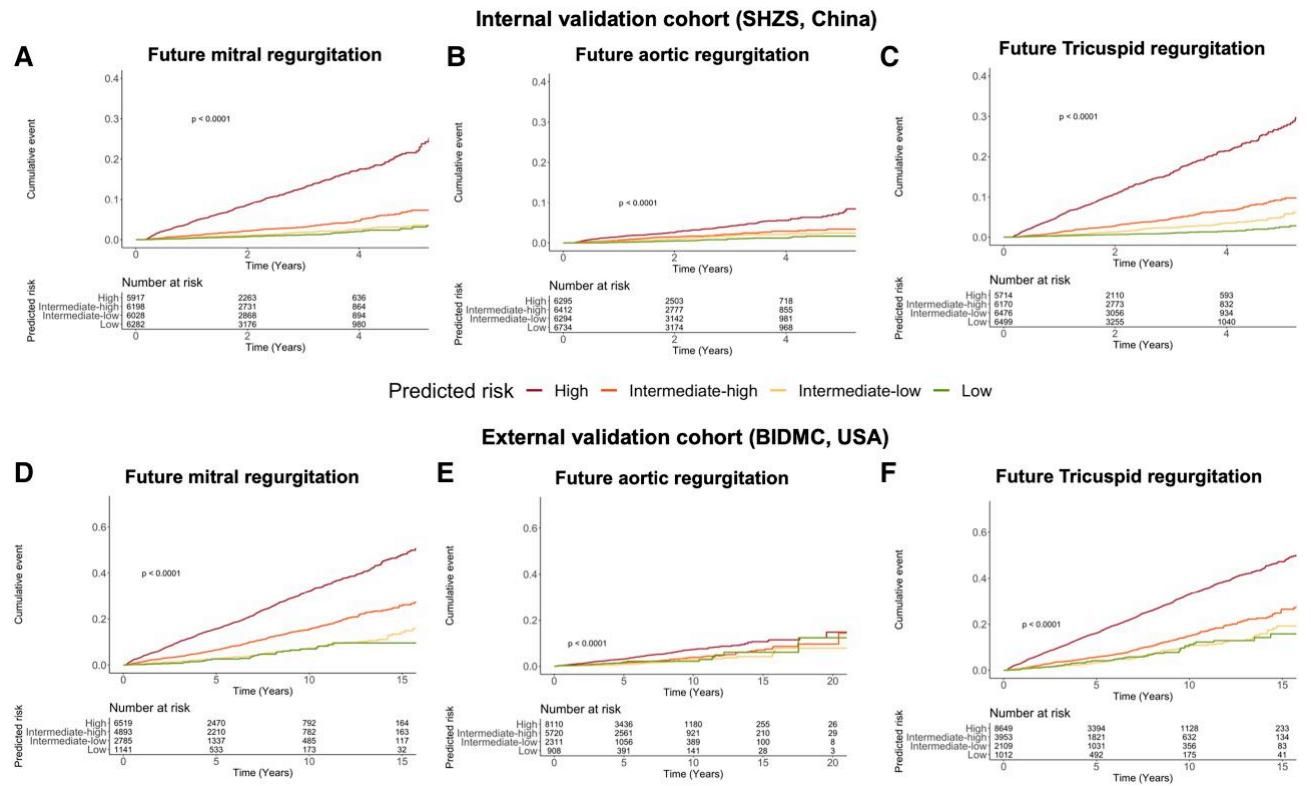
从图[3]中可以看到,代表“高风险”的红色曲线与其他曲线迅速分离,且呈现陡峭的上升趋势。在调整了年龄和性别因素后,高风险组未来发生严重二尖瓣反流的风险是低风险组的7.6倍;而对于三尖瓣反流,这一风险倍数更是惊人地达到了9.9倍。这意味着,如果你被AI判定为“高风险”,即使此刻你的心脏超声显示一切正常,未来几年内出现严重瓣膜问题的概率也极高。这种强大的预判能力,正是临床医生梦寐以求的“早期预警雷达”。
3. 跨越山海:经受住跨人种验证的“通用AI”
医学AI模型常常面临“水土不服”的质疑:在一个国家训练的模型,换到另一个医疗体系或人种中,往往会因为数据分布的差异而“失灵”。众所周知,不同人种之间在心电图特征上存在细微的生理性差异,这曾是阻碍跨国界AI应用的一大鸿沟。
本研究最令人信服的一点,正在于其经受住了这种“跨洋测试”。研究团队将在这个以东亚人群为主(上海中山医院)训练出的模型,直接应用于以白人为主的美国波士顿BIDMC人群中。尽管两个队列在疾病发生率、患者基础状况(BIDMC队列更偏向二级护理,患者病情更重)上存在显著差异,AI模型依然表现出了稳健的预测能力。
更进一步的亚组分析显示,该模型并非“偏科生”。如图[4]所示,研究人员将美国队列按性别和种族(白人、黑人、西班牙裔、亚裔等)进行了细分,并分别计算了预测准确度。
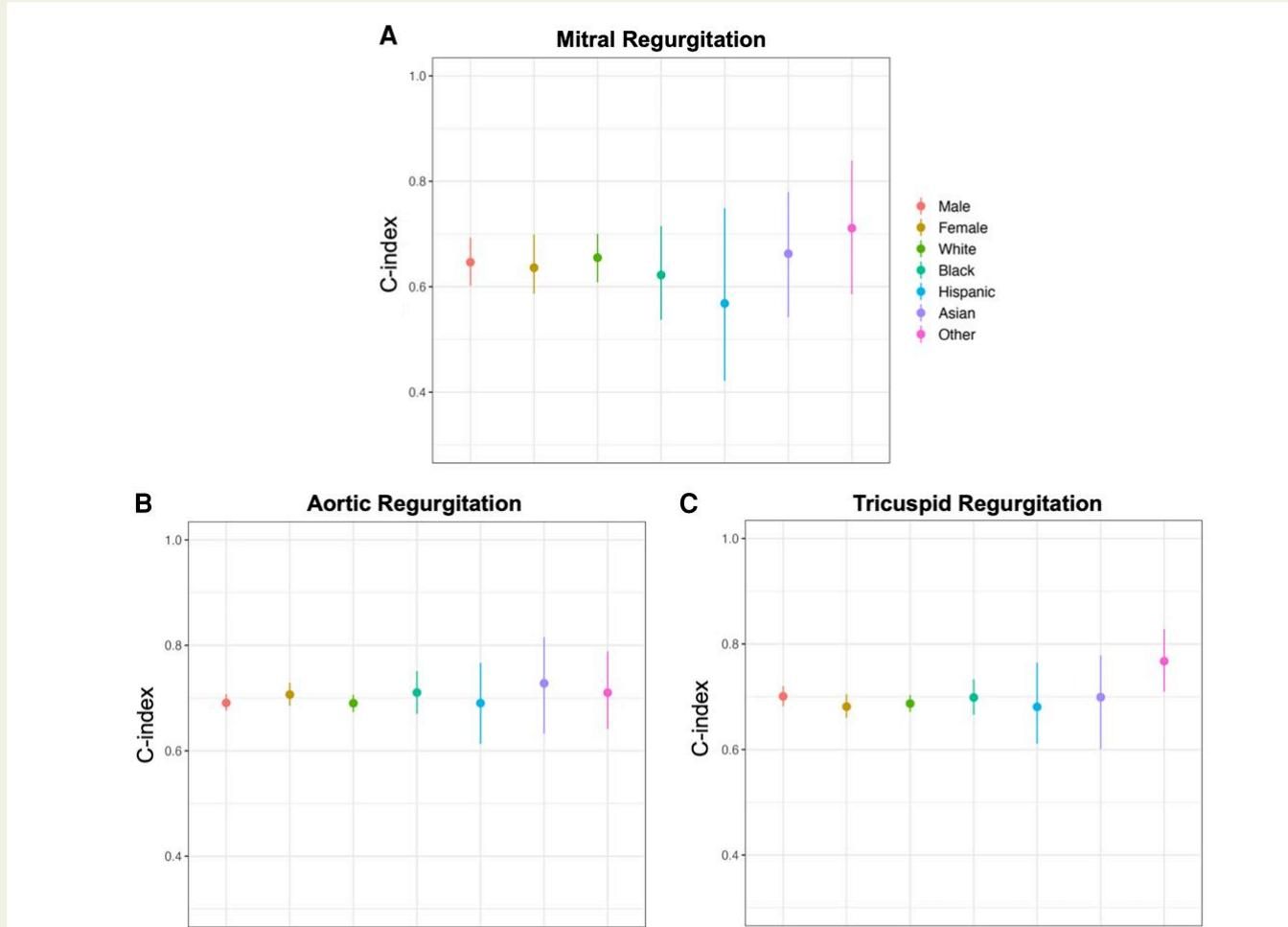
从图[4]中我们可以看到,各个人种亚组的C指数(C-index)点估计值(彩色圆点)在垂直方向上排列相对紧凑,且置信区间(垂直线段)多有重叠。这表明,无论你是白人、黑人还是亚裔,AI模型预测二尖瓣、主动脉瓣或三尖瓣反流风险的准确性都是高度一致的。这种跨种族的普适性,为该技术未来在全球范围内的推广奠定了坚实的基础。
4. 揭秘黑盒:AI究竟“看”到了什么?
很多人会问:心电图记录的只是心脏的电活动,而瓣膜病是心脏结构的机械性改变,AI凭什么能通过“电”来预测“机械”故障?是AI学会了玄学吗?
当然不是。研究团队通过“可解释性分析”揭开了AI的决策逻辑:它捕捉到了人类肉眼难以察觉的亚临床心脏重构(Subclinical Chamber Remodelling)信号。简单来说,在瓣膜病发展到严重的临床阶段之前,心脏为了适应血液动力学的改变,心房和心室的微观结构和电生理特性已经开始悄悄发生变化。
为了验证这一点,研究人员将AI评分与超声心动图的具体参数进行了关联分析。如图[5]所示,这张气泡图直观地展示了AI评分与心脏结构参数之间的相关性。气泡的颜色代表不同的解剖部位(如紫色代表左心房,绿色代表左心室),位置越靠右代表正相关性越强。
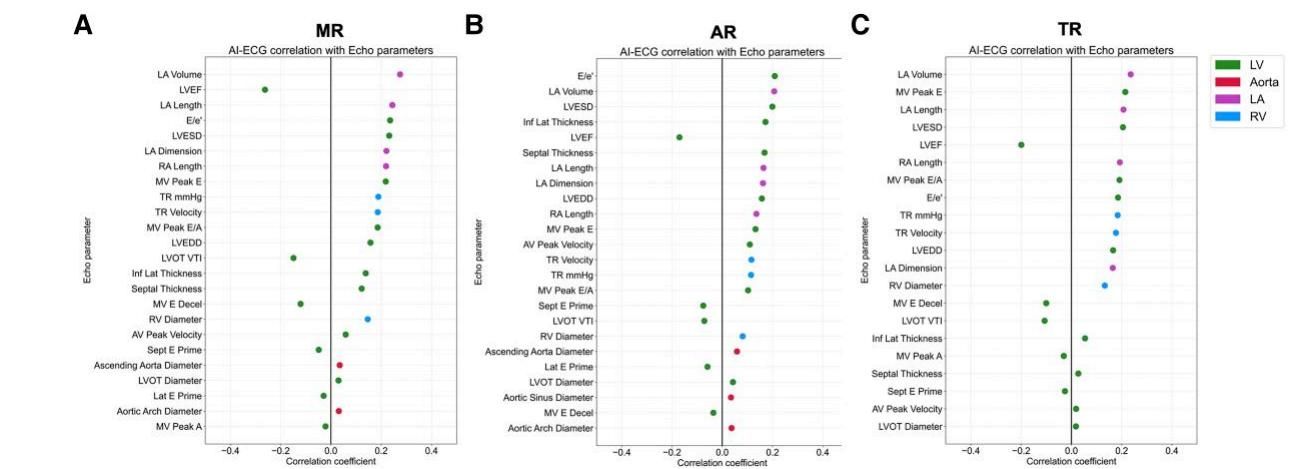
从图[5]中可以解读出关键信息:
- 二尖瓣反流(MR,图A)的AI预测值与左心房(LA)的体积和大小高度相关。这完全符合病理生理学机制——二尖瓣反流会导致左心房压力升高和扩张。
- 主动脉瓣反流(AR,图B)的预测值则更多地与左心室(LV)的重构参数(如左室舒张末期内径)相关。
- 三尖瓣反流(TR,图C)的预测则同时关联了右心房和右心室的指标。
这说明,AI并非在进行毫无根据的猜测,而是敏锐地识别出了那些预示着心脏正在发生病理性重构的电信号特征(如P波形态改变、QRS波群增宽等),从而实现了对未来风险的“降维打击”。
5. 改写指南:从“定期复查”到“精准监测”
这项研究的临床价值在于它提供了一种优化医疗资源配置的全新思路。目前的临床指南建议对所有轻度瓣膜病患者进行定期超声监测,这不仅效率低下,而且对于那些看似健康但实则高危的人群(隐形病人)束手无策。
引入AI心电图模型后,我们或许可以重构未来的诊疗流程:
- 分级监测:利用几乎零成本的心电图对人群进行筛查。被AI标记为“高风险”的患者,应缩短超声检查间隔(例如每半年或一年一次),并尽早通过药物控制高血压等合并症;而被标记为“低风险”的人群,则可以安全地减少不必要的检查频率。
- 机会性筛查:在智能手表和可穿戴设备普及的今天,这种AI算法有望植入到日常监测设备中。当你的手表提示“未来瓣膜风险升高”时,它可能比任何体检中心都能更早地提醒你去医院做个详细检查。
论文信息
- 标题:Artificial intelligence-enhanced electrocardiography to predict regurgitant valvular heart diseases: an international study.
- 论文链接:https://doi.org/10.1093/eurheartj/ehaf448
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-11-21
- 期刊/会议:European heart journal
- 作者:Yixiu Liang, Arunashis Sau, Boroumand Zeidaabadi, ..., Fu Siong Ng
本文由超能文献“资讯AI智能体”基于4000万篇Pubmed文献自主选题与撰写,并经AI核查及编辑团队二次人工审校。内容仅供学术交流参考,不代表任何医学建议。
分享




